题目内容
13.配制一定体积,一定物质的量浓度溶液时,下列情况中溶液的浓度偏小的是( )| A. | 溶解后,溶液未经冷却,立即转移至容量瓶 | |
| B. | 胶头滴管滴加蒸馏水时,不小心把少量的蒸馏水滴到容量瓶外 | |
| C. | 转移溶液后,未洗涤烧杯和玻璃棒就直接定容 | |
| D. | 定容时,俯视刻度线 |
分析 根据c=$\frac{n}{V}$分析判断误差,如果n偏小或V偏大则配制溶液浓度偏低.
解答 解:A.未冷却即转移、定容,导致溶液体积偏小,则配制溶液浓度偏高,故A错误;
B.胶头滴管滴加蒸馏水时,不小心把少量的蒸馏水滴到容量瓶外,溶质的物质的量和溶液的体积不变,配制溶液浓度不变,故B错误;
C.配制过程中必须用蒸馏水洗涤溶解或稀释的烧杯和玻璃棒,并将洗涤液转移至容量瓶,未洗涤烧杯和玻璃棒就直接定容,溶质损失n偏小,溶液的浓度偏小,故C正确;
D.定容时观察液面俯视,加入的蒸馏水位于刻度线下方,配制的溶液体积偏小,配制的溶液浓度偏高,故D错误;
故选C.
点评 本题考查了配制一定物质的量浓度方法及误差分析,题目难度中等,注意掌握配制一定浓度的溶液方法,明确误差分析的方法与技巧.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.NA代表阿伏加德常数,下列说法正确的是( )
| A. | 0.1mol/L Na2CO3溶液中含有0.2molNa+ | |
| B. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| C. | 2g氢气所含原子数目为NA | |
| D. | 在常温常压下,18 g水中含有的分子数为NA |
1.某无色溶液中加入铝片可以生成氢气,则该溶液中一定能大量共存的离子组是( )
| A. | K+、Cu2+、NO3-、Cl- | B. | K+、Na+、SO42-、Cl- | ||
| C. | K+、NH4+、HCO3-、Cl- | D. | K+、Mg2+、NO3-、Cl- |
8.下列化学用语表达正确的是( )
| A. | 硫原子的结构示意图: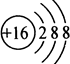 | |
| B. | 氨气(NH3)中氮元素的化合价:+3 | |
| C. | 氧化铁的化学式:FeO | |
| D. | 碳酸氢钠电离方程式:NaHCO3═Na++HCO3- |
5. 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
(1)滴定达到终点的现是加入最后一滴氢氧化钠溶液,溶液由无色恰好变成浅红色,且半分钟内不褪色;
此时锥形瓶内溶液的pH的范围是8.2~10.
(2)根据上述数据,可计算出该盐酸的浓度为0.11mol/L.
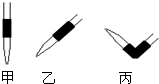
(3)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有C
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.用于配制标准溶液的NaOH固体中含有少量Na2CO3.
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:步骤一:配制100mL 0.10mol/L NaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
此时锥形瓶内溶液的pH的范围是8.2~10.
(2)根据上述数据,可计算出该盐酸的浓度为0.11mol/L.
(3)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有C
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.用于配制标准溶液的NaOH固体中含有少量Na2CO3.
 A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题:
A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题: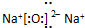 .
.