题目内容
1.某无色溶液中加入铝片可以生成氢气,则该溶液中一定能大量共存的离子组是( )| A. | K+、Cu2+、NO3-、Cl- | B. | K+、Na+、SO42-、Cl- | ||
| C. | K+、NH4+、HCO3-、Cl- | D. | K+、Mg2+、NO3-、Cl- |
分析 无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,加入铝能够生成氢气,溶液中才大量氢离子或氢氧根离子,
A.铜离子为有色离子,不满足溶液无色的条件;
B.四种离子之间不反应,都不与氢离子和氢氧根离子反应,且为无色溶液;
C.铵根离子与氢氧根离子反应,碳酸氢根离子与氢离子和氢氧根离子反应;
D.镁离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,加入铝不会生成氢气.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,加入铝片可以生成氢气的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.Cu2+为有色离子,不满足溶液无色的要求,故A错误;
B.K+、Na+、SO42-、Cl-之间不发生反应,都不与氢离子和氢氧根离子反应,且为无色溶液,在溶液中能够大量共存,故B正确;
C.NH4+、HCO3-都与氢氧根离子反应,HCO3-还能够与氢离子反应,在溶液中一定不能大量共存,故C错误;
D.Mg2+与氢氧根离子反应生成氢氧化镁沉淀,NO3-在酸性条件下具有氧化性,加入铝不可能生成氢气,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”.

练习册系列答案
相关题目
11.中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示.下列叙述正确的是( )


| A. | M的相对分子质量是180 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量NaHCO3反应能生成2 mol CO2 |
16.下列实验中,所采用的分离或提纯与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离氯化钠和碘的固体混合物 | 加热法 | 碘单质易升华 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去NaOH溶液中的Na2SO4 | 加适量的BaCl2后过滤 | BaSO4难溶 |
| A. | A | B. | B | C. | C | D. | D |
6.能用来区别NH4Cl、NaCl、Na2CO3三种物质的试剂(必要时可以加热)是( )
| A. | AgNO3溶液 | B. | 稀硫酸 | C. | 稀盐酸 | D. | Ba(OH)2溶液 |
13.配制一定体积,一定物质的量浓度溶液时,下列情况中溶液的浓度偏小的是( )
| A. | 溶解后,溶液未经冷却,立即转移至容量瓶 | |
| B. | 胶头滴管滴加蒸馏水时,不小心把少量的蒸馏水滴到容量瓶外 | |
| C. | 转移溶液后,未洗涤烧杯和玻璃棒就直接定容 | |
| D. | 定容时,俯视刻度线 |
10.已知:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,有关该反应的说法正确的是( )
| A. | 该反应中铜单质在反应过程中得到电子 | |
| B. | 该反应中浓硝酸被氧化 | |
| C. | 该反应中硝酸只表现氧化性 | |
| D. | 该反应中浓硝酸是氧化剂 |
11.已知在密闭容器中发生的反应:H2(g)+I2(g)?2HI(g)△H<0.若改变下列条件,则其反应速率发生的变化是(在表格的相应空格内填“√”)
| 序号 | 改变条件 | 反应速率变化 | ||
| 增大 | 减小 | 不变 | ||
| (1) | 升高温度 | |||
| (2) | 充入更多的H2 | |||
| (3) | 扩大容器的体积 | |||
| (4) | 定容充入氦气 | |||

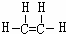 ,B中官能团的电子式为
,B中官能团的电子式为 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.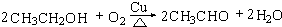 .
.