题目内容
【题目】CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1
CO(g)+3H2(g) △H1=+206.1kJmol—1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJmol—1
CH3OH(l) △H2=-128.3kJmol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJmol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.
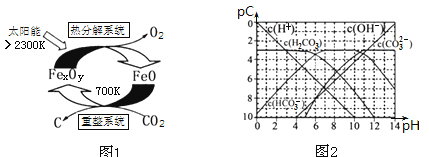
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
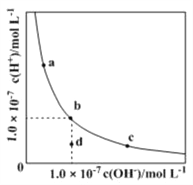
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2molL—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。
【答案】 2CH4(g)+O2 (g)![]() 2CH3OH(l) △H=-328.0kJmol—1 实验2或2 实验3或3 > Fe3O4 11.2L H+、HCO3— 随着pH增大、HCO3—电离使pC(HCO3—)增大,H2CO3电离使pC(HCO3—)减小 10-6
2CH3OH(l) △H=-328.0kJmol—1 实验2或2 实验3或3 > Fe3O4 11.2L H+、HCO3— 随着pH增大、HCO3—电离使pC(HCO3—)增大,H2CO3电离使pC(HCO3—)减小 10-6
【解析】(1)甲烷和氧气合成液态甲醇的热化学方程式(①+②)![]() 2+②得:2CH4(g)+O2 (g)
2+②得:2CH4(g)+O2 (g)![]() 2CH3OH(l) △H=-328.0kJmol—1。
2CH3OH(l) △H=-328.0kJmol—1。
(2)由图数据知Ⅰ、实验1、是标准。实验2和实验3是通过和实验1,探究温度、压强对反应①的影响有数据可知实验2是改变温度,实验3是改变压强,温度和压强都比实验1大,所以反应开始时正反应速率最快的是实验2和实验3;因为①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1是吸热反应,升高温度平衡向正反应方向进行,CH4的转化率增大,又是一个气体体积增大的反应,增大压强,平衡逆向移动,CH4的转化率减小。所以实验3平衡时CH4的转化率最小。
CO(g)+3H2(g) △H1=+206.1kJmol—1是吸热反应,升高温度平衡向正反应方向进行,CH4的转化率增大,又是一个气体体积增大的反应,增大压强,平衡逆向移动,CH4的转化率减小。所以实验3平衡时CH4的转化率最小。
Ⅱ、结合上述分析,实验2和实验3相比,其平衡常数关系:K2>K3
(3) ①由图分析:CO2![]() C 转移电子4mol且n(FeO)∶n(CO2)=6∶1 FexOy
C 转移电子4mol且n(FeO)∶n(CO2)=6∶1 FexOy![]() FeO。由此确定FexOy化学式为Fe3O4
FeO。由此确定FexOy化学式为Fe3O4
因为FexOy为Fe3O4,分解时发生反应为 2 Fe3O4=6FeO + O2![]() ,分解l mol,同时生成标准状况下气体体积为11.2L。
,分解l mol,同时生成标准状况下气体体积为11.2L。
(4)①根据图像在0<pH<4时,H2CO3溶液中主要存在的离子是H+、HCO3—,
②根据图像在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是随着pH增大、HCO3—电离使pC(HCO3—)增大,H2CO3电离使pC(HCO3—)减小。
③根据题意pC=﹣lg(1×10—2)=2知C(H2CO3)= 1×10—2 molL—1由图知C(HCO3—)= 1×10—3 molL—1 C(H+)= 1×10—5 molL—1H2CO3一级电离平衡常数的数值Ka1=(C(HCO3—).C(H+))/C(H2CO3)= 10-6答案:10-6

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案