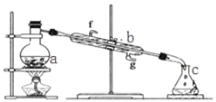
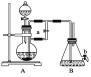
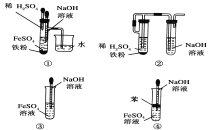
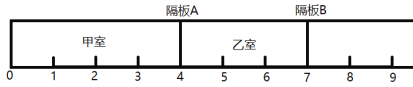
题目内容
【题目】下列物质分类正确的是( )
A.Na2O2、Fe3O4、CuO均为碱性氧化物
B.盐酸、水玻璃、氨水均为混合物
C.烧碱、冰醋酸、四氯化碳均为电解质
D.稀豆浆、硅酸、氯化铁溶液均为胶体
【答案】B
【解析】解:A.和酸反应生成盐和水的氧化物为碱性氧化物,Fe3O4、CaO均为碱性氧化物,Na2O2和酸反应生成盐和水同时生成氧气,不是碱性氧化物,故A错误;
B.盐酸是氯化氢的水溶液、水玻璃是硅酸钠的水溶液、氨水为氨气的水溶液均为混合物,故B正确;
C.烧碱、冰醋酸水溶液中导电均为电解质,四氯化碳不能电离为非电解质,故C错误;
D.稀豆浆、硅酸粒子直径在1﹣100nm之间均为胶体,氯化铁溶液不是胶体,故D错误;
故选B.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( )
氧化物 | 环境问题 | 主要来源 | |
A | CO2 | 酸雨 | 化石燃料的燃烧 |
B | CO | CO中毒 | 汽车尾气和化石燃料的不完全燃烧 |
C | NO2 | 温室效应 | 工厂废气的排放 |
D | SO2 | 光化学烟雾 | 汽车尾气的排放 |
A.A
B.B
C.C
D.D
【题目】CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1
CO(g)+3H2(g) △H1=+206.1kJmol—1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJmol—1
CH3OH(l) △H2=-128.3kJmol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJmol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.
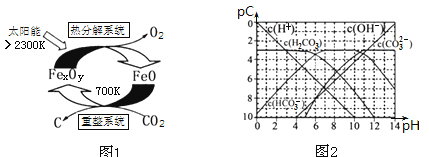
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2molL—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。