题目内容
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.工业上可用铝热反应大规模炼铁
B.SO2常用于纸张等植物纤维的漂白
C.Si是重要的半导体材料
D.电解熔融MgCl2 , 可制得金属镁
【答案】A
【解析】解:A.Al为活泼金属,且Al比Fe价格高,工业上应选焦炭还原金属氧化物,不能利用铝热反应制备Fe,故A错误;
B.SO2具有漂白性,则常用于纸张等植物纤维的漂白,故B正确;
C.Si位于金属与非金属的交界处,具有金属与非金属的性质,则Si是重要的半导体材料,故C正确;
D.Mg为活泼金属,则电解熔融MgCl2,可制得金属镁,故D正确;
故选A.

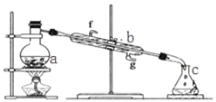
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。
Ⅰ.制备苯甲酸和回收未反应的甲苯
反应原理:
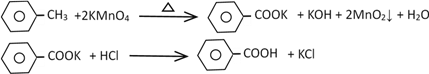
第1步:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应;
第2步:过滤反应混合物,得到滤液;经过操作Ⅰ,得到有机层和水层;
第3步:向有机层中加无水Na2SO4,过滤,经过操作Ⅱ,得到无色液体A;
第4步:向水层加入浓盐酸酸化,蒸发浓缩,冷却,过滤,得到白色固体B;
已知:
相对分子质量 | 熔点 | 沸点 | 密度 | 溶解度 | |
甲苯 | 92 | -95℃ | 110.8℃ | 0.8669g·mL-1 | 极微溶于水 |
苯甲酸 | 122 | 122.4℃ | 249℃ | 1.2659 g·mL-1 | 0.3g (25℃时) 6.9g (95℃时) |
(1)操作Ⅰ所用的玻璃仪器有烧杯和______________,操作Ⅱ为________________。
(2)第3步中加入无水Na2SO4的目的是_____________________,无色液体A是_______。
Ⅱ.提纯粗苯甲酸
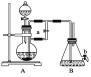
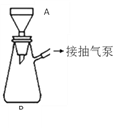
该同学利用重结晶的方法对得到的B进行提纯。重结晶的过程:加热溶解→趁热抽滤→冷却结晶→抽滤→洗涤→干燥→纯苯甲酸。(注:抽滤装置如图所示,主要仪器有A布氏漏斗,B抽滤瓶,抽气泵等)
(3)白色固体B中的杂质是____________。
(4)趁热抽滤得到的滤液放置冷却可以结晶出纯净的苯甲酸晶体,为了得到更多的苯甲酸,是不是温度越低越好并说明理由______(填“是”或“不是”),理由__________________________________________________________。
(5)使用抽滤装置比普通过滤装置的优点是_______________________________________。
(6)实验中取甲苯10.0 mL,制得苯甲酸8.0g,本次实验中苯甲酸的产率为____________(结果保留到小数点后一位)。
【题目】CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1
CO(g)+3H2(g) △H1=+206.1kJmol—1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJmol—1
CH3OH(l) △H2=-128.3kJmol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJmol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.
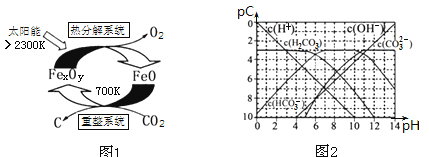
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
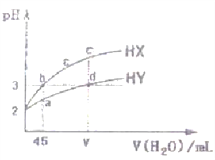
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2molL—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。
【题目】I.阅读、分析下列两个材料:
材料一
材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/ g/cm3 | 溶解性 |
乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填字母序号):
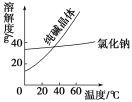
(1)从含少量NaCl的Na2CO3中提纯Na2CO3的操作为溶解、_________、________、过滤、洗涤、干燥
(2)将乙二醇和丙三醇相互分离的最佳方法是_________。
A.蒸馏法 B.萃取法 C.结晶法 D.分液法
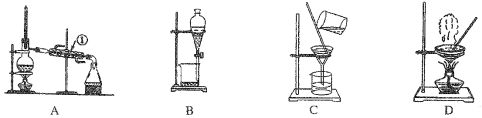
II.青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下
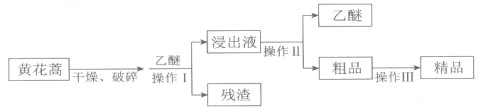
操作I、II中,不会用到的装置是________(填序号)。
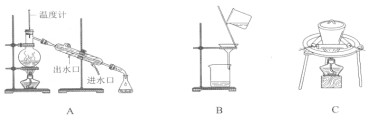
Ⅲ.实验室用98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的H2SO4溶液470mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、___________、__________。
(2)其操作步骤可分解为以下几步:
A.用量筒量取______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):____________
( D )→( A )→ → → → →( F )。
(3)下列操作会使所配稀硫酸浓度偏高的是______________。
A、取用浓硫酸时仰视刻度线
B、容量瓶用蒸馏水洗涤后用1.2mol/L的硫酸润洗
C、转移溶液时,不慎有少量溶液洒出
D、定容时仰视容量瓶刻度线
E、将稀释后的稀硫酸立即转入容量瓶且进行后面的实验操作
F、定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴 蒸馏水至刻度线