��Ŀ����
����Ŀ����ѧ�ҿ�����һ�����ྻú��������ͨ�������ú��������¯���н�����������ˮ�����ķ�����������������ֵ��ú̿��������Ҫ�ɷ���CO��H2��������¯������Ҫ��Ӧ�У�C(s)+ +H2O (g) =CO(g)+H2(g) ��H= +131.3 kJmol-1
CO(g)+H2O(g) =CO2(g)+H2(g) ��H= �� 41.2kJmol-1
��1������¯��CO2��C��Ӧת��ΪCO���÷�Ӧ���Ȼ�ѧ����ʽ�� __________________________________��
��2����ú̿���ϳɼ״��ķ�ӦΪCO(g)+2H2(g) ![]() CH3OH(g)�����ܱ������У���CO��H2�����ʵ���1��2��Ϸ�Ӧ��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CH3OH(g)�����ܱ������У���CO��H2�����ʵ���1��2��Ϸ�Ӧ��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
�����ɼ״��ķ�ӦΪ_______��������������������������
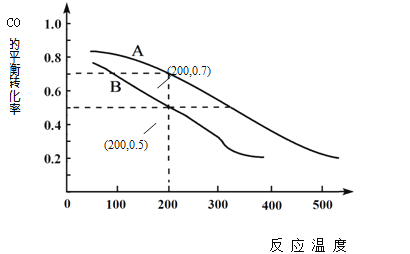
��ͼ���������߷ֱ��ʾѹǿΪ0.1MPa��5.0MPa��COת�������¶ȵı仯�����д���ѹǿ��5.0MPa��������____________������A������B������
���ڲ��ı䷴Ӧ��������ǰ���£�Ϊ���COת���ʿɲ�ȡ�Ĵ�ʩ�� _______________________ ��
��ѹǿΪ0.1MPa���¶�Ϊ200��ʱ��ƽ�������м״������ʵ��������� _______________��
��3��ij���͵��������̼����������ʣ���650���¹���������ͨ��ú̿��������ͨ�������CO2�Ļ��������ص�������ӦʽΪO2+2CO2+4e-=2CO32����������ӦʽΪ ___________________��_________________��
���𰸡� C(s)+CO2(g)=2CO(g) ��H=+172.5 kJmol-1 ���� A ���¡���ѹ 25% H2+CO32--2e-=H2O+CO2 CO+CO32--2e-= 2CO2
����������. ��֪�� C(s)+ +H2O (g) =CO(g)+H2(g) ��H= +131.3 kJmol-1
�� CO(g)+H2O(g) =CO2(g)+H2(g) ��H= ��41.2kJmol-1�����ø�˹���ɽ��٣��ڿɵã�C(s)+CO2(g)=2CO(g) ��H=+172.5 kJmol-1���ʴ�Ϊ��C(s)+CO2(g)=2CO(g) ��H=+172.5 kJmol-1��
��. ��. ��ͼ���֪�����¶ȵ�����CO��ƽ��ת���ʽ��ͣ�˵������ʱƽ�������ƶ���������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
��. �ӷ�Ӧ����ʽ��֪���÷�ӦΪ���������С�ķ�Ӧ������ѹǿ����ʱƽ�������ƶ���CO��ƽ��ת������������ת���ʸߵ�ѹǿ�ʴ�Ϊ��A��
��. Ϊ���CO��ת���ʣ���Ҫʹƽ�������ƶ������ݷ�Ӧ����ʽ��֪������ѹǿ����ʹƽ�������ƶ�������÷�Ӧ�Ƿ��ȷ�Ӧ�����Խ����¶�Ҳ����ʹƽ�������ƶ����ʴ�Ϊ����������ѹ��
��. ���ܱ������У���CO��H2�����ʵ���1:2��ϣ�����ʼʱ����CO amol�������H2 2amol�����ͼ���֪��ѹǿΪ0.1MPa���¶�Ϊ200��ʱ��CO��ƽ��ת����Ϊ0.5�����������ʽ���У�
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
��ʼ(mol) a 2a 0
ת��(mol) 0.5a a 0.5a
ƽ��(mol) 0.5a a 0.5a
����ƽ�������м״������ʵ�����������![]() ��100%=25%���ʴ�Ϊ��25%��
��100%=25%���ʴ�Ϊ��25%��
��. ú̿������Ҫ�ɷ���CO��H2��������͵�ص��ܷ�ӦΪ����O2+2CO=2CO2�͢�2H2+O2=2H2O����õ�ص�������ӦʽΪ��O2+2CO2+4e��=2CO32�������ݸ�����Ӧʽ=����ܷ�Ӧʽ��������Ӧʽ����-�ۿɵã�2CO+2CO32����4e��=4CO2�������CO+CO32����2e��=2CO2����-�ۿɵã�2H2+2CO32����4e��=2H2O+2CO2�������H2+CO32����2e��=H2O+CO2��
�ʴ�Ϊ��H2+CO32����2e��=H2O+CO2��CO+CO32����2e��=2CO2��

����Ŀ��������㷺Ӧ������ҩ�ͻ�����ҵ��ijͬѧ�����üױ���������Ӧ�Ʊ������ᡣ
�����Ʊ�������ͻ���δ��Ӧ�ļױ�
��Ӧԭ����

��1����һ�����ļױ���KMnO4��Һ��100����Ӧһ��ʱ���ֹͣ��Ӧ��
��2�������˷�Ӧ�����õ���Һ�����������õ��л����ˮ�㣻
��3�������л����м���ˮNa2SO4�����ˣ����������õ���ɫҺ��A��
��4������ˮ�����Ũ�����ữ������Ũ������ȴ�����ˣ��õ���ɫ����B��
��֪��
��Է������� | �۵� | �е� | �ܶ� | �ܽ�� | |
�ױ� | 92 | ��95�� | 110.8�� | 0.8669g��mL��1 | ������ˮ |
������ | 122 | 122.4�� | 249�� | 1.2659 g��mL��1 | 0.3g (25��ʱ) 6.9g (95��ʱ) |
��1�����������õIJ����������ձ���______________��������Ϊ________________��
��2����3���м�����ˮNa2SO4��Ŀ����_____________________����ɫҺ��A��_______��
�����ᴿ�ֱ�����
��ͬѧ�����ؽᾧ�ķ����Եõ���B�����ᴿ���ؽᾧ�Ĺ��̣������ܽ�����ȳ��ˡ���ȴ�ᾧ�����ˡ�ϴ�ӡ�������������ᡣ��ע������װ����ͼ��ʾ����Ҫ������A����©����B����ƿ�������õȣ�

��3����ɫ����B�е�������____________��
��4�����ȳ��˵õ�����Һ������ȴ���Խᾧ�������ı����ᾧ�壬Ϊ�˵õ�����ı����ᣬ�Dz����¶�Խ��Խ�ò�˵������______����ǡ����ǡ���������__________________________________________________________��
��5��ʹ�ó���װ�ñ���ͨ����װ�õ��ŵ���_______________________________________��
��6��ʵ����ȡ�ױ�10.0 mL���Ƶñ�����8.0g������ʵ���б�����IJ���Ϊ____________�����������С�����һλ����
����Ŀ�����·ǽ�����������������Ļ������⼰��Ҫ��Դ��Ӧ��ȷ���ǣ�������
������ | �������� | ��Ҫ��Դ | |
A | CO2 | ���� | ��ʯȼ�ϵ�ȼ�� |
B | CO | CO�ж� | ����β���ͻ�ʯȼ�ϵIJ���ȫȼ�� |
C | NO2 | ����ЧӦ | �����������ŷ� |
D | SO2 | �⻯ѧ���� | ����β�����ŷ� |
A.A
B.B
C.C
D.D
����Ŀ��CH4��CO2��̼�ᶼ��̼����Ҫ�����ʵ��̼���仯������ת�����Կ�������Դ�ͽ���̼�ŷ������ش�
��1����֪����CH4(g)��H2O(g)![]() CO(g)��3H2(g) ��H1����206.1kJmol��1
CO(g)��3H2(g) ��H1����206.1kJmol��1
��2H2(g)��CO(g)![]() CH3OH(l) ��H2����128.3kJmol��1
CH3OH(l) ��H2����128.3kJmol��1
��2H2(g)��O2(g)��2H2O(g) ��H3����483.6kJmol��1
д���ɼ���������ϳ�Һ̬�״����Ȼ�ѧ����ʽ��_____________________��
��2�������÷�Ӧ�����Ʊ�������Ϊ��̽���¶ȡ�ѹǿ�Է�Ӧ����Ӱ�죬�����������Ա�ʵ�飨�¶�Ϊ400����500����ѹǿΪ101kPa��404kPa����
ʵ����� | �¶�/�� | ѹǿ/kPa | CH4��ʼŨ��/ mol��L��1 | H2O��ʼŨ��/ mol��L��1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
��ʵ��1��ʵ��2��ʵ��3�Ƚϣ���Ӧ��ʼʱ����Ӧ����������_________��ƽ��ʱCH4��ת������С����_________��
��ʵ��2��ʵ��3��ȣ���ƽ�ⳣ����ϵ��K2______K3����������������������=������
��3����ѧ�������CO2��ȡ̼��C����̫���ܹ�����ͼ1��ʾ��

�١�����ϵͳ�������ķ�Ӧ��n(FeO)��n(CO2)��6��1����FexOy�Ļ�ѧʽΪ______��
�ڡ��ȷֽ�ϵͳ����ÿ�ֽ�l mol FexOy��ͬʱ���ɱ�״�����������Ϊ_______��
��4��pC����pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ø�����ֵ����ij��Һ�����ʵ�Ũ��Ϊ1��10��2molL��1�������Һ�����ʵ�pC����lg(1��10��2)��2����ͼ2Ϊ25��ʱH2CO3��Һ��pC��pHͼ����ش��������⣺
��
����8��pH��10ʱ����Һ��HCO3����pCֵ������pH�������С��ԭ����____��
����H2CO3һ������ƽ�ⳣ������ֵKa1�� _______________��