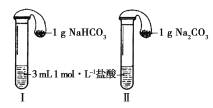
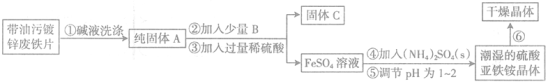
题目内容
【题目】(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。

【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
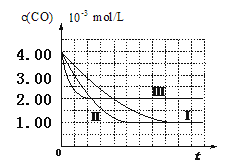
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________; NO 的转化率为
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2![]() 2NH3
2NH3
(1)在N2+3H2![]() 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
(3)在一个绝热(与外界没有热交换)、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变 B.容器内温度不再变化 C.断裂1mol N≡N键的同时,生成6 mol N—H键 D. 2v正(H2)=3v逆(NH3) E.反应混合气体的平均相对分子质量不变 F.C(H2): C(N2): C(NH3)= 3:1:2
【答案】
(Ⅰ)(1)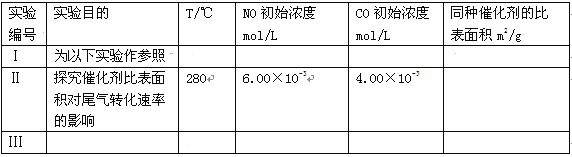 (2)3.00×10-3 mol/L;50%(3)增大
(2)3.00×10-3 mol/L;50%(3)增大
(Ⅱ)(1)B(2)D (3)BDE
【解析】
试题分析:(Ⅰ)(1)探究一种影响因素,必须保持其他影响因素是一致,通过对比Ⅱ和Ⅰ的条件可知,两者的区别是催化剂的比表面积不同,故其他的影响因素均应相同,故Ⅱ中温度为280T,NO初始浓度为6.50×10-3mol/L,CO初始浓度为4.00×10-3mol/L,而且Ⅱ探究的是催化剂比表面积对尾气转化速率的影响,
故答案为:

(2)通过图象可知,平衡时CO的平衡浓度为1.00×10-3mol/L,可得出CO的浓度该变量△c(CO)=4.00×10-3mol/L-1.00×10-3mol/L=3.00×10-3mol/L,在一个反应中,各物质的浓度的改变量之比等于计量数之比,故NO的浓度的该变量△c(NO)=3.00×10-3mol/L,故NO的平衡浓度c(NO)=6.00×10-3mol/L-3.00×10-3mol/L=3.00×10-3mol/L,转化率α ![]() =
=![]() =50%
=50%
故答案为:3.00×10-3mol/L;
(3)由图象可知,增大催化剂比表面积后,缩短了到达平衡的时间,故增大了反应速率。
故答案为:增大。
(II)(1)由于v(N2)=0.15mol/(Ls),速率之比等于化学计量数之比,所以v(NH3)=2v(N2)=2×0.15mol/(Ls)=0.3mol/(Ls),所以反应所经历的时间为 0.9mol/L÷0.3mol/(Ls)=3s,
故答案为:B;
(2)反应为N2(g)+3H2(g)2NH3(g),以氢气的反应速率为标准进行判断:
A.v(H2)=0.1molL-1min-1;B.v(N2)=0.1molL-1min-1,反应速率之比等于其计量数之比,所以v(H2)=3v(N2)=0.3molL-1min-1;C.v(NH3)=0.15molL-1min-1,反应速率之比等于其计量数之比,所以v(H2)=1.5v(NH3)=0.225mol/(Lmin);D.v(N2)=0.002molL-1s-1=0.12molL-1min-1,反应速率之比等于其计量数之比,所以v(H2)=3v(N2)=0.36mol/(Lmin),所以反应速率最快的是D。
故答案为:D;
(3)A.根据质量守恒,反应前后混合气体的质量不变,容器的体积不变,所以混合气体的密度始终不变,不能证明该反应是否达到平衡状态,故A错误;B.该反应放热,容器内温度不再变化,能证明该反应是达到平衡状态,故B正确;C.无论反应是否平衡,断裂1molN≡N键的同时,肯定生成6molN-H键,不能证明该反应达到平衡状态,故C错误;D.无论反应是否平衡,始终有2v正(H2)=3v正(NH3),现已知2v正(H2)=3v逆(NH3),可得v正(NH3) =v逆(NH3),则说明反应已达平衡,故D正确;E.根据质量守恒,反应前后混合气体的质量不变,如果反应混合气体的平均相对分子质量不变,则说明容器中混合气体的物质的量不再变化,由于该反应是气体体积减小的反应,说明该反应已达平衡,故E正确;F.容器中N2、H2、NH3浓度之比可能为1:3:2,也可能不等,与各物质的初始浓度及转化率有关,故F错误。
故答案为:BDE。

【题目】参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数。
(b)碘值是使100g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的_________________多,黄油比牛油的_________________小。硬化大
豆油的碘值小的原因是_________ ________。
(3)为使碘值为180的鱼油100 g硬化所需要的H2的体积为 升(标准状况下)?
(4)结构简式为 的酯,若皂化值为430,求n为
的酯,若皂化值为430,求n为