题目内容
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4 ![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
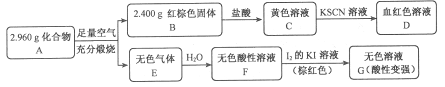
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
【答案】Ⅰ.(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气。
(2)Al2O3 +2OH![]() 2AlO2+H2O
2AlO2+H2O
(3)NH4Cl+H2O ![]() NH3·H2O+HCl,MgO+2 HCl
NH3·H2O+HCl,MgO+2 HCl ![]() MgCl2+H2O
MgCl2+H2O
Ⅱ.(1)S、Fe Fe3S4
(2)制印刷电路板
(3)![]() Fe3S4+6H+
Fe3S4+6H+![]() 3H2S↑+3Fe2++S
3H2S↑+3Fe2++S
(4)H2SO3+I2+H2O![]() H2SO4+2HI
H2SO4+2HI
取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42,过滤后取滤液,滴加H2O2溶液,若产生白色沉淀,则有H2SO3。
【解析】
试题分析:Ⅰ.(1)此反应为吸热反应,能降低问题,反应产生的固体氧化物能隔绝空气,并且产生水蒸气,可以稀释空气。故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气。
(2)氧化镁和氧化铝的区别在于氧化铝能与强碱反应而氧化镁不能,氧化铝和强碱反应生成偏铝酸盐和水,离子方程式为:Al2O3 +2OH![]() 2AlO2+H2O。(3)氯化铵溶液中铵根离子水解, NH4Cl+H2O
2AlO2+H2O。(3)氯化铵溶液中铵根离子水解, NH4Cl+H2O ![]() NH3·H2O+HCl,溶液为酸性,氧化镁和水解生成的盐酸反应生成氯化镁,方程式为: MgO+2HCl
NH3·H2O+HCl,溶液为酸性,氧化镁和水解生成的盐酸反应生成氯化镁,方程式为: MgO+2HCl ![]() MgCl2+H2O。Ⅱ.(1)红棕色固体B为氧化铁,与盐酸反应后生成黄色溶液C为氯化铁,氯化铁与硫氰化钾显血红色溶液D为硫氰化铁。无色气体溶于水后为酸性,与碘反应后生成无色溶液,酸性变强,说明原酸为弱酸,且具有还原性,为亚硫酸,则无色气体为二氧化硫。则原化合物中含有铁和硫元素。氧化铁的质量为2.400g,其物质的量为2.400/160=0.015mol,含铁原子的物质的量为0.030mol,则铁的质量为0.030×56=1.680g,则化合物中硫元素的质量为2.960-1.680=1.280g,硫的物质的量为1.280/32=0.040mol,则铁与硫的物质的量比为0.030:0.040=3:4,则化学式为:Fe3S4。(2)溶液C为氯化铁,可以溶解铜,用来制印刷电路板。(3)化合物A与硫酸反应生成淡黄色不溶物为硫,和一种气体,该气体的摩尔质量为1.518×22.4=34.00,则为硫化氢。硫化氢的电子式为
MgCl2+H2O。Ⅱ.(1)红棕色固体B为氧化铁,与盐酸反应后生成黄色溶液C为氯化铁,氯化铁与硫氰化钾显血红色溶液D为硫氰化铁。无色气体溶于水后为酸性,与碘反应后生成无色溶液,酸性变强,说明原酸为弱酸,且具有还原性,为亚硫酸,则无色气体为二氧化硫。则原化合物中含有铁和硫元素。氧化铁的质量为2.400g,其物质的量为2.400/160=0.015mol,含铁原子的物质的量为0.030mol,则铁的质量为0.030×56=1.680g,则化合物中硫元素的质量为2.960-1.680=1.280g,硫的物质的量为1.280/32=0.040mol,则铁与硫的物质的量比为0.030:0.040=3:4,则化学式为:Fe3S4。(2)溶液C为氯化铁,可以溶解铜,用来制印刷电路板。(3)化合物A与硫酸反应生成淡黄色不溶物为硫,和一种气体,该气体的摩尔质量为1.518×22.4=34.00,则为硫化氢。硫化氢的电子式为![]() ,该反应生成硫酸亚铁和硫和硫化氢,方程式为:Fe3S4+6H+
,该反应生成硫酸亚铁和硫和硫化氢,方程式为:Fe3S4+6H+![]() 3H2S↑+3Fe2++S。(4)亚硫酸和碘单质反应生成硫酸和氢碘酸,方程式为:H2SO3+I2+H2O
3H2S↑+3Fe2++S。(4)亚硫酸和碘单质反应生成硫酸和氢碘酸,方程式为:H2SO3+I2+H2O![]() H2SO4+2HI;溶液G中主要含有硫酸根离子,或许有未反应完的亚硫酸分子,硫酸根离子用钡盐检验,亚硫酸可以用氧化剂氧化成硫酸根再检验,具体操作方法为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO4/span>2,过滤后取滤液,滴加H2O2溶液,若产生白色沉淀,则有H2SO3。
H2SO4+2HI;溶液G中主要含有硫酸根离子,或许有未反应完的亚硫酸分子,硫酸根离子用钡盐检验,亚硫酸可以用氧化剂氧化成硫酸根再检验,具体操作方法为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO4/span>2,过滤后取滤液,滴加H2O2溶液,若产生白色沉淀,则有H2SO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
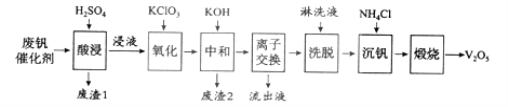
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。