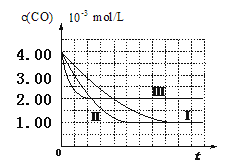
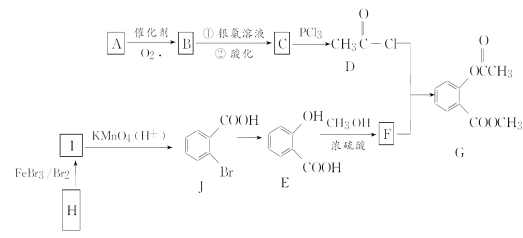
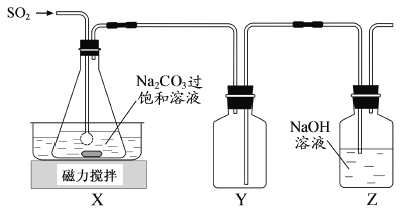
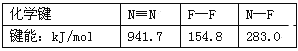题目内容
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
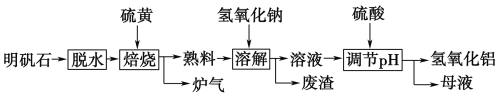
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S2Al2O3+________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________。
(2)“溶解”时反应的离子方程式为___________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是_________________。
(4)“母液”中可回收的物质是__________________________。
(5)工业上常用氢氧化铝脱水后的产物X熔融电解冶炼金属铝,则该反应的化学方程式是_________。
【答案】(1)9SO2↑,Al2(SO4)3,12;(2)Al2O3+2OH-===2AlO2-+H2O;(3)取最后一次洗涤的滤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;(4)K2SO4、Na2SO4;(5)2Al2O3(熔融)4Al+3O2↑。
【解析】
试题分析:(1)根据化学反应方程式,元素守恒和原子守恒,相差9个S和18个O,因此缺少的是9个SO2,SO42-中S的化合价降低,S的化合价升高,因此氧化剂是Al2(SO4)3,被氧化的元素是化合价升高的元素,即S单质,物质的量为3molS,被还原的元素是化合价降低的元素,即SO42-中的S,其物质的量为6mol,因此两者的质量比为1:3;(2)熟料中含有Al2O3和Fe2O3、K2SO4,其中Al2O3属于两性氧化物,Fe2O3属于碱性氧化物,因此有Al2O3+2OH-=2AlO2-+H2O;(3)Al(OH)3表面有K2SO4,只要检验SO42-即可,操作:取最后一次洗涤的滤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;(4)根据流程的分析,母液中含有杂质为Na2SO4和K2SO4;(5)脱水的产物是X,则X为Al2O3,因此电解反应方程式为:2Al2O3(熔融) ![]() 4Al+3O2↑。
4Al+3O2↑。