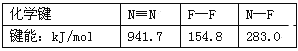��Ŀ����
����Ŀ��ijʵ��С��̽��Na2CO3��NaHCO3�����ʣ�����ʵ������ʢ�����ֹ�����Լ�ƿ��ʧ�˱�ǩ�����ǣ������ȶԹ���A��B���м�����ͨ��ʵ���������̽����
��1���ֱ���ȹ���A��B�����ֹ���A���Ȳ�����������ʹ����ʯ��ˮ����ǡ�A���ȷֽ�Ļ�ѧ����ʽΪ_______________________��
��2����ȡ���ֹ����2 g���ֱ��������С�ձ��У��ٸ���10 mL����ˮ���������¶ȱ仯�����������ܽ⣬�ָ������£���������Һ�и�����2�η�̪��Һ��
������Na2CO3������ȫ�ܽ⣬��NaHCO3������ʣ�࣬�ɴ˵ó����ۣ�____________________��
��ͬѧ�������ձ��л��۲쵽������������ʢ��Na2CO3���ձ��г��ֵ�������________(����ĸ���)��
a����Һ�¶��½� b����Һ�¶�����
c�������̪���dz��ɫ d�������̪��ʺ�ɫ
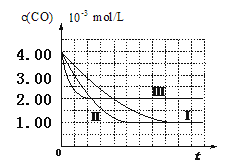
��3����ͼ��ʾ�������������õ�װ���������зֱ����ҩƷ���������ڵĹ���ͬʱ�����Թ��С�
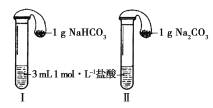
�����Թ��о��������壬________(����������������)�ķ�Ӧ�̶ȸ�Ϊ���ҡ�
����Ӧ����������������ͣ��ָ������£�����˵����ȷ����________(����ĸ���)��
a��װ��������������ϴ�
b��װ��������������ϴ�
c�������������������������
d�����������������ݹ������
��4��ͬѧ�ǽ����ֹ���ֱ����Ƴ�0.5 mol��L��1����Һ��������·������Է�Ӧ��������Ԥ�⣺
ʵ�鷽�� | Ԥ������ | Ԥ������ |
����1����2 mL Na2CO3��Һ�еμ�1 mL 0.5 mol��L��1 CaCl2��Һ | �а�ɫ���� | Na2CO3��Һ�е�CO32��Ũ�Ƚϴ�����CaCl2������Ӧ��________(д���ӷ���ʽ) |
����2����2 mL NaHCO3��Һ�еμ�1 mL 0.5 mol��L��1 CaCl2��Һ | �ް�ɫ���� | NaHCO3��Һ�е�CO32��Ũ�Ⱥ�С��������CaCl2��Ӧ |
ʵʩʵ����ֲ���2��������Ԥ���в��죺������ɫ���������壬��������£�NaHCO3��Һ��CaCl2��Һ��Ӧ�����ӷ���ʽΪ________________��
���𰸡���1��2NaHCO3Na2CO3��CO2����H2O����2������ͬ�¶��£�Na2CO3��NaHCO3������ˮ����b��d����3���٢�a��c����4��Ca2����CO32��===CaCO3����Ca2����2HCO3��===CaCO3����CO2����H2O��
��������
�����������1��NaHCO3���ȶ��ԲNa2CO3���ȶ���ǿ�����2NaHCO3![]() Na2CO3��CO2����H2O����2������ͬ�¶��£�NaHCO3���ܽ��С��Na2CO3�ܽ�ȣ���Na2CO3����ˮ�Ƿ��ȹ��̣���Һ�¶����ߣ���ͬ��Ũ���£�Na2CO3��pH����NaHCO3�������bd��ȷ����3����Na2CO3�����ᷴӦ������NaHCO3��Ȼ��NaHCO3�ں�HCl��Ӧ����CO2����˷�Ӧ���ҵ���I����װ�â���n(NaHCO3)��0.011 9 mol��װ�â���n(Na2CO3)��0.009 4 mol�����Թ���n(HCl)��0.003 mol�����Թ��������������������������������Ӧ����������㣬c�ԣ�װ�â��з�����Ӧ�����ӷ���ʽΪHCO3����H��===CO2����H2O����װ�â��з�����Ӧ�����ӷ���ʽΪCO32����H��===HCO3����HCO3����H��===CO2����H2O����װ�â��в����������װ�â��в���������࣬a�ԣ���4������1�У����ݸ��ֽⷴӦ�������������ӷ�Ӧ����ʽΪCa2����CO32��=CaCO3����������ɫ����������ΪCaCO3��CO2��������ӷ�Ӧ����ʽΪ��Ca2����2HCO3��=CaCO3����CO2����H2O��
Na2CO3��CO2����H2O����2������ͬ�¶��£�NaHCO3���ܽ��С��Na2CO3�ܽ�ȣ���Na2CO3����ˮ�Ƿ��ȹ��̣���Һ�¶����ߣ���ͬ��Ũ���£�Na2CO3��pH����NaHCO3�������bd��ȷ����3����Na2CO3�����ᷴӦ������NaHCO3��Ȼ��NaHCO3�ں�HCl��Ӧ����CO2����˷�Ӧ���ҵ���I����װ�â���n(NaHCO3)��0.011 9 mol��װ�â���n(Na2CO3)��0.009 4 mol�����Թ���n(HCl)��0.003 mol�����Թ��������������������������������Ӧ����������㣬c�ԣ�װ�â��з�����Ӧ�����ӷ���ʽΪHCO3����H��===CO2����H2O����װ�â��з�����Ӧ�����ӷ���ʽΪCO32����H��===HCO3����HCO3����H��===CO2����H2O����װ�â��в����������װ�â��в���������࣬a�ԣ���4������1�У����ݸ��ֽⷴӦ�������������ӷ�Ӧ����ʽΪCa2����CO32��=CaCO3����������ɫ����������ΪCaCO3��CO2��������ӷ�Ӧ����ʽΪ��Ca2����2HCO3��=CaCO3����CO2����H2O��

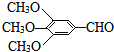
����Ŀ����1���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���ȼ�ϡ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�����Ҫ��Ӧ���£�
��CO��g��+2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H2= ��58 kJ/mol
CH3OH��g��+H2O��g�� ��H2= ��58 kJ/mol
��CO2��g��+H2��g��![]() CO��g��+H2O��g�� ��H3
CO��g��+H2O��g�� ��H3
��֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C ��CO�еĻ�ѧ���� | H��O | C��H |
E/��kJ/mol�� | 436 | 343 | 1076 | 465 | 413 |
�ش��������⣺
����H3=_____kJ/mol
��25����101 kPa�����£����16g�״���ȫȼ���ͷų�Q kJ����������д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ_______________
��2��25������a mol��L��1��ˮ��b mol��L��1����������Ϻ���Һ�����ԣ����ʱ��Һ��c��NH4+��__________c��Cl����������������������������ú�a��b�Ĵ���ʽ��ʾ���¶���NH3��H2O�ĵ���ƽ�ⳣ��Kb = _________
��3��800��ʱ����2L�ܱ������з�����Ӧ2NO��g����O2��g��![]() 2NO2��g�����ڷ�Ӧ��ϵ�У�n��NO����ʱ��ı仯���±���ʾ��
2NO2��g�����ڷ�Ӧ��ϵ�У�n��NO����ʱ��ı仯���±���ʾ��
ʱ����s�� | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
����ͼ�б�ʾNO2�仯��������___________��O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v��____
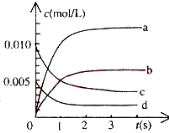
����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����_______
a��v��NO2��=2v��O2��
b��������ѹǿ���ֲ���
c��v����NO����2v����O2��
d�������ڵ��ܶȱ��ֲ���