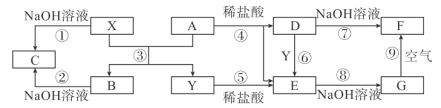
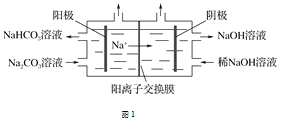
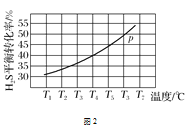
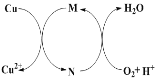题目内容
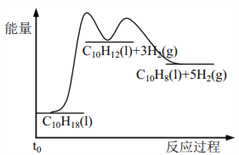
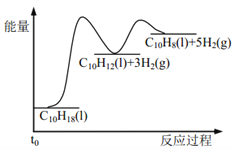
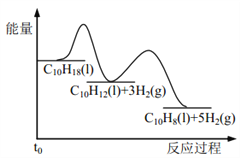
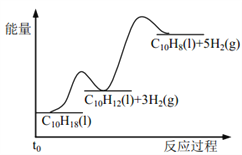
【题目】反应![]()
![]() ,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开![]() 键的数目和生成
键的数目和生成![]() 键的数目相等
键的数目相等
D.容器内气体的浓度![]()
【答案】A
【解析】
A.该反应为放热反应,反应在恒压绝热容器中进行,当容器内的温度不再变化时,说明放出的热量不再变化,表明反应已达平衡状态,故A正确;
B.因反应在恒压条件下进行,反应中压强始终不变,故压强不再变化不能表明反应一定已达平衡状态,故B错误;
C.断开![]() 键和生成
键和生成![]() 键均表示正反应,则相同时间内,断开
键均表示正反应,则相同时间内,断开![]() 键的数目和生成
键的数目和生成![]() 键的数目相等不能表明反应一定已达平衡状态,故C错误;
键的数目相等不能表明反应一定已达平衡状态,故C错误;
D.容器内气体的浓度![]() 与反应的起始状态有关,不能表明反应一定已达平衡状态,故D错误;
与反应的起始状态有关,不能表明反应一定已达平衡状态,故D错误;
故选A。

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目