题目内容
【题目】现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH
请回答:
(1)写出⑤的官能团的名称______。
(2)与①互为同系物的是______(填序号)。
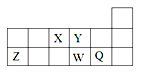
(3)写出④ 的同分异构体的结构简式________________。
(4)写出与②发生加成反应生成乙烷的化学方程式_________________________。
(5)③与⑤发生反应的化学方程式______________________。
【答案】 羧基 ④ CH3 CH (CH3 )CH3 ![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
【解析】从结构简式可知,①CH4甲烷属于烷烃,②CH2=CH2属于烯烃,官能团为碳碳双键,③CH3CH2OH属于醇,官能团为羟基,④ CH3CH2CH2CH3属于烷烃,⑤CH3COOH属于羧酸,官能团为羧基。以此分析。
(1) ⑤的官能团的名称为羧基,本题答案为:羧基;
(2) ①CH4和④ CH3CH2CH2CH3都属于烷烃,结构相似,分子组成相差3个CH2原子团,互为同系物,本题答案为④;
(3) CH3CH2CH2CH3为正丁烷,它的同分异构体为异丁烷CH3CH(CH3)CH3;
(4)乙烯CH2=CH2和氢气发生加成反应生成乙烷,化学方程式为:
![]() ;
;
(5)CH3CH2OH与CH3COOH在浓硫酸加热条件下,发生反应生成乙酸乙酯和水,化学方程式
CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。

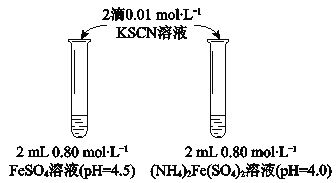
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________,原因是__________________。
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________。
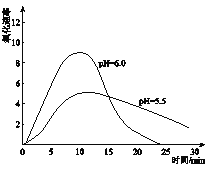
(6)综合以上实验,增强Fe2+稳定性的措施有_________________。