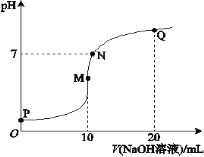
题目内容
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
【答案】核素 同位素 ![]() 和
和![]() 30 24 7 5
30 24 7 5
【解析】
结合核素的结构分析即可。
(1)![]() 、
、![]() 的质子数均为1,中子数分别为0、1,分别是氢元素的一种核素,它们互为同位素;
的质子数均为1,中子数分别为0、1,分别是氢元素的一种核素,它们互为同位素;
(2)![]() 和
和![]() 是由
是由![]() 元素组成的两种不同单质,互为同素异形体;
元素组成的两种不同单质,互为同素异形体;
(3)![]() 的质子数为26,质量数为56,中子数为
的质子数为26,质量数为56,中子数为![]() ,核外电子数为
,核外电子数为![]() ;
;
(4)9种微粒中含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 5种元素,含有
5种元素,含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 7种核素。
7种核素。

练习册系列答案
相关题目