题目内容
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)B的基态原子核外电子排布式为____________________。
(2)BF3的立体构型是_____________________;HF能与BF3化合得到HBF4,从化学键形成角度分析HF与BF3能化合的原因___________。
(3)H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4]-,H3BO3 和[B(OH)4]-中B的杂化轨道类型分别为为____________ 、____________。
(4)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_____________,其中三种元素的电负性由大到小的顺序是__________________________。
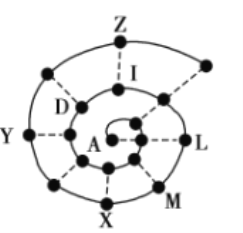
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O,其结构如图所示,
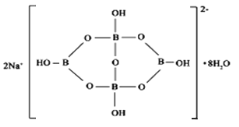
它的阴离子可形成链状结构,则该晶体中不存在的作用力是_________(填选项字母)。
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
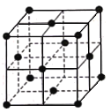
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图所示,其堆积方式为____________,Li+占据阴离子组成的所有最小正四面体中心,该化合物的化学式为____________(用最简整数比表示)。假设晶胞边长为a pm,用NA代表阿伏加德罗常数的值,则该晶胞的密度为___________g/cm3(用含a,NA的代数式表示) 。
【答案】1s22s22p1 平面(正)三角形 BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键 sp2杂化 sp3杂化  H>B>Na D 面心立方最密堆积 LiB6H6 6.32×1032 /(a3·NA)
H>B>Na D 面心立方最密堆积 LiB6H6 6.32×1032 /(a3·NA)
【解析】
(1)B元素处于第二周期IIIA族,核外电子排布式为1s22s22p1 。
故答案为1s22s22p1
(2)BF3分子的中心B原子孤电子对数=![]() =0,价层电子对数=3+0=3,分子空间构型为平面正三角形,中心B原子的杂化轨道类型为sp2,故BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键得到HBF4。
=0,价层电子对数=3+0=3,分子空间构型为平面正三角形,中心B原子的杂化轨道类型为sp2,故BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键得到HBF4。
故答案为 平面(正)三角形 BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键
(3)H3BO3中B原子的价层电子对数为3,故B原子的杂化轨道类型为SP2,[B(OH)4]-中B原子的价层电子数为4,孤对电子数为0,故B原子的杂化轨道类型为SP3杂化。
故答案为 sp2杂化 sp3杂化
(4)NaBH4为离子化合物,电子式为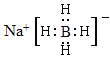 ,NaBH4中H的化合价为-1,电负性大于B,故电负性大小比较为:H>B>Na。
,NaBH4中H的化合价为-1,电负性大于B,故电负性大小比较为:H>B>Na。
故答案为 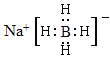 H>B>Na
H>B>Na
(5)Na2[B4O5(OH)4]·8H2O中含有离子键,形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键,图1中用“→”标出其中的配位键为: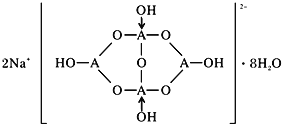 ,该阴离子通过氢键相互结合形成链状结构,故含有共价键、氢键及范德华力的作用,不存在金属键。
,该阴离子通过氢键相互结合形成链状结构,故含有共价键、氢键及范德华力的作用,不存在金属键。
故答案选D
(6)由图可知阴离子处于晶胞的顶点和面心,属于面心立方最密堆积,顶点阴离子与面心阴离子构成正四面体结构,晶胞中有8个正四面体故有8个Li+,故该化合物的化学式为LiB6H6,晶体密度=晶胞的密度=![]() 。
。
故答案为 LiB6H6 6.32×1032 /(a3·NA)

 阅读快车系列答案
阅读快车系列答案