题目内容
【题目】氮的固定意义重大,氮肥的使用大面积提高了粮食产量。人工固氮最有效的方法是合成氦,一种工业合成氨的简易流程如图所示(净化、后期处理等流程未列出):

回答下列问题:
Ⅰ.步骤A制氢气的原理之一是CH4(g)+2H2O(g)CO2(g)+4H2(g) H=a kJ/mol
(1)已知:H2、CH4的燃烧热分别为285.8kJ/mol、890.31k/mol;H2O(g)H2O(l) H=-44kJ/mol则a=____kJ/mol。
(2)在密闭容器中,既能加快反应速率,又一定能提高平衡体系中H2体积分数的措施是_____(填序号)。
a.加入催化剂 b.升高温度 c.降低压强 d.增大c(H2O)
Ⅱ.步骤B完成了原料气准备后,通过步骤C合成氨,其原理为N2(g)+3H2(g)![]() 2NH3(g) H=-92.4kJ/mol。
2NH3(g) H=-92.4kJ/mol。
(3)若T℃下,向一个容积为2L的真空密闭容器中(有催化剂)通入lmol N2、3mol H2,1分钟后达到化学平衡状态,测得容器内的压强是开始时的0.8倍。则:
①下列叙述可说明该反应已经达到化学平衡状态的是______(填序号)。
a.3v(H2)正=2v(NH3)逆 b.混合气体的平均相对分子质量不再发生改变
c.混合气体的密度不再发生改变 d. 1个N≡N键断裂的同时有3个H—H键生成
②t分钟内v(H2)=_______。
③T℃下该反应的K=___________(列出计算式即可)。
④一定条件下,向体积相同的甲(含催化剂)、乙两个容器中分别充入等物质的量的N2和等物质的量的H2进行合成氨反应,均反应1小时、测得N2的转化率随温度变化如图所示,a、b、c三点中达到化学平衡状态的点有_________,乙装置中N2转化率随着温度的升高先升后降的原因可能是______。

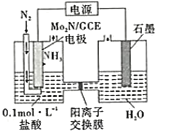
(4)我国科学家成功研制出一种高效电催化固氮催化剂Mo2N,其固氮原理如图所示,该装置中,阴极上的电极反应式为______。
【答案】+164.89 b bd ![]() mol/(L·min)
mol/(L·min) 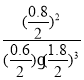 ac 因合成氨反应的H<0,随温度升高N2的转化率应降低,但c点之前N2转化率增大,说明反应未达平衡状态,c点后为随温度升高平衡逆向移动的结果 N2+6H++6e-=2NH3
ac 因合成氨反应的H<0,随温度升高N2的转化率应降低,但c点之前N2转化率增大,说明反应未达平衡状态,c点后为随温度升高平衡逆向移动的结果 N2+6H++6e-=2NH3
【解析】
(1)因为 ①H2(g)+![]() O2(g)=H2O(l) H=-285.8kJ/mol,②CH4(g)+2O2(g)= CO2(g)+2H2O(l) H=-890.31k/mol,③H2O(g)H2O(l) H=-44kJ/mol,根据盖斯定律②-①
O2(g)=H2O(l) H=-285.8kJ/mol,②CH4(g)+2O2(g)= CO2(g)+2H2O(l) H=-890.31k/mol,③H2O(g)H2O(l) H=-44kJ/mol,根据盖斯定律②-①![]() 4+③
4+③![]() 2得:CH4(g)+2H2O(g) CO2(g)+4H2(g) H=+164.89kJ/mol,故答案:+164.89;
2得:CH4(g)+2H2O(g) CO2(g)+4H2(g) H=+164.89kJ/mol,故答案:+164.89;
(2)根据CH4(g)+2H2O(g)CO2(g)+4H2(g) H=+164.89 kJ/mol,在密闭容器中进行的反应:
a.加入催化剂不会改变化学平衡移动,故a 不符合题意;
b.升高温度既能加快反应速率,又能使平衡向着吸热方向移动,即提高了平衡体系中H2体积分数,故b 符合题意;
c.降低压强反应速率 减慢,故c不符合题意;
d.增大c(H2O),没有注明状态,无法判断,故d不符合题意;
故答案:b。
(3)①a.根据N2(g)+3H2(g)![]() 2NH3(g) H=-92.4kJ/mol反应,若T℃下2v(H2)正=3v(NH3)逆说明该反应已经达到化学平衡状态,故a不符合题意;
2NH3(g) H=-92.4kJ/mol反应,若T℃下2v(H2)正=3v(NH3)逆说明该反应已经达到化学平衡状态,故a不符合题意;
b.混合气体的平均相对分子质量数值等于摩尔质量=![]() ,气体的总质量是个定值,而反应前后化学计量数不等,所以当混合气体的平均相对分子质量不再发生改变,说明该反应已经达到化学平衡状态,故b符合题意;
,气体的总质量是个定值,而反应前后化学计量数不等,所以当混合气体的平均相对分子质量不再发生改变,说明该反应已经达到化学平衡状态,故b符合题意;
c.混合气体的密度=![]() ,因为体积一定,气体的质量不变,所以混合气体的密度是定值,故混合气体的密度不再发生改变,不说明该反应已经达到化学平衡状态,故c不符合题意;
,因为体积一定,气体的质量不变,所以混合气体的密度是定值,故混合气体的密度不再发生改变,不说明该反应已经达到化学平衡状态,故c不符合题意;
d. 1个N≡N键断裂说明反应正向进行,同时有3个H—H键生成说明反应逆向进行,且正逆反应速率相等,故1个N≡N键断裂的同时有3个H—H键生成可以证明该反应已经达到化学平衡状态,故d符合题意;
故答案:bd。
②若T℃下根据反应可知
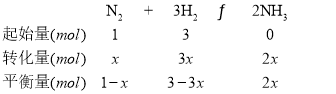
根据阿伏加德罗定律:![]() =
=![]() ,即
,即![]() =
=![]() ,解得x=0.4,所以 t分钟内v(H2)=
,解得x=0.4,所以 t分钟内v(H2)=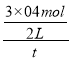 =
=![]() mol/(L·min);
mol/(L·min);
③T℃下该反应的平衡常数K=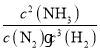 =
=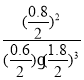 ;
;
④由图像可知,a点随温度的升高,N2的转化率应降低,说明平衡逆向移,所以a点是反应达到平衡点;因合成氨反应的H<0,随温度升高N2的转化率应降低,但c点之前乙装置中 N2转化率增大,说明反应未达平衡状态,c点后为随温度升高平衡逆向移动和正向移动的交点,所以c点是达到平衡的点,故答案:ac;因合成氨反应的H<0,随温度升高N2的转化率应降低,但c点之前乙装置中 N2转化率增大,说明反应未达平衡状态,c点后为随温度升高平衡逆向移动的结果;
(4)由装置图进料口可知:充入N2的一端为阴极,得电子发生还原反应,电解质溶液为稀盐酸,所以阴极上的电极反应式为N2+6H++6e-=2NH3,故答案:N2+6H++6e-=2NH3。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案