题目内容
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
则甲烷水蒸气重整反应的ΔH=_____kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
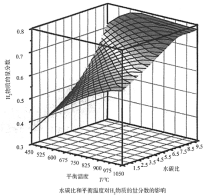
①温度一定时,H2的物质的量分数与水碳比(1~10)的关系是_____,产生该结论的原因是_____。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为_____,其压强平衡常数为_____;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率v=_____。
(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
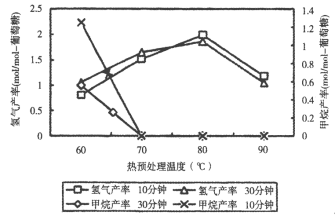
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为_____。
【答案】+206.3 水碳比越大,H2的物质的量分数越大 水碳比较大时,CO会与H2O进一步反应生成H2,使H2的物质量分数增大 66.7% 4.32×10-2(Mpa)2 ![]() 80℃
80℃
【解析】
(1)①+④2×②2×③即得甲烷水蒸气的重整反应方程式,用盖斯定律求甲烷水蒸气重整反应的△H;
(2)①H2的物质的量分数与水碳比(1~10)的关系由图知;原因从生成氢气的反应角度来回答;
②平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,列三段式求解CH4的转化率、压强平衡常数;根据压强与气体物质的量成正比,结合三段式计算;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,提高H2的产率的最佳温度,由图可知。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
②CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
③H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
④CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
根据盖斯定律,①+④2×②2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)CO(g)+3H2(g),则甲烷水蒸气的重整反应△H=△H1+△H42△H22△H3=(890.341+2×283.0+2×285.8)kJmol1=+206.3 kJmol1;
(2)①平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系,由图中曲线走势可知,水碳比越大,H2的物质的量分数越大的原因,从生成氢气的反应可知,除了甲烷水蒸气的重整反应生成氢气外,一氧化碳和水也会反应产生氢气;
②操作压强为0.1MPa、平衡温度为900℃条件下,水碳比为1.0时,H2的物质的量分数为0.6,设甲烷和H2O的物质的量均为3mol,达化学平衡时,甲烷消耗xmol,则:
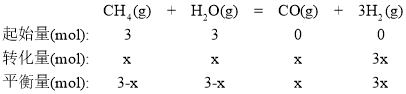
H2的物质的量分数=![]() =
=![]() =0.6,解得x=2mol,转化率α(CH4)=
=0.6,解得x=2mol,转化率α(CH4)=![]() ×100%=
×100%=![]() ×100%=66.67%,平衡常数K=
×100%=66.67%,平衡常数K=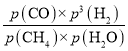 =
=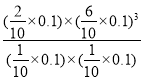 (Mpa)2=4.32×10-2(Mpa)2;反应速率v=kp(CH4)p-1(H2)=k
(Mpa)2=4.32×10-2(Mpa)2;反应速率v=kp(CH4)p-1(H2)=k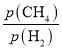 =k
=k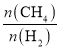 =k×
=k×![]() =
=![]() ;
;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,由图可知,pH为5.5时,若要提高H2的产率,降低甲烷产率,最佳温度为80℃。