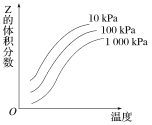
题目内容
【题目】已知:CH4(g)+4NO3(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48 LCH4还原NO2至N2,整个过程中转移的电子总数________(阿伏伽德罗常数用NA表示),放出的热量为_________kJ。
【答案】1.6NA 173.4
【解析】
CH4(g)与NO2(g)反应生成N2(g)的化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)。①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJmol-1,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJmol-1将![]() (①+②)可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=
(①+②)可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=![]() =-867kJ/mol,4.48 LCH4的物质的量为
=-867kJ/mol,4.48 LCH4的物质的量为![]() =0.2mol,反应中N由+4价变成0价,转移的电子总数为0.2mol×2×(4-0)×NA/mol= 1.6NA,放出的热量为867kJ/mol×0.2mol=173.4 kJ,故答案为:1.6NA;173.4。
=0.2mol,反应中N由+4价变成0价,转移的电子总数为0.2mol×2×(4-0)×NA/mol= 1.6NA,放出的热量为867kJ/mol×0.2mol=173.4 kJ,故答案为:1.6NA;173.4。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目