题目内容
【题目】Na2CO3和NaHCO3是两种常见的钠盐.
(1)用洁净的铂丝蘸取Na2CO3粉末置于酒精灯火焰上灼烧,火焰呈_____色.
(2)等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下产生CO2的体积V(Na2CO3)_____V(NaHCO3)(填“大于”,“小于”或“等于”)
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为_____.
(4)实验室中需2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量是_____.
A. 1000mL; 212g B.950mL;543.4g C.任意规格; 572g D.500mL; 106g
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是_____(填下列编号);
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.定容观察液面时俯视
C.未冷却至室温就开始定容
D.加蒸馏水时不慎超过了刻度.
【答案】黄 小于 32.8% A BC
【解析】
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,发生焰色反应,火焰呈黄色;
(2)等质量的Na2CO3和NaHCO3,碳酸氢钠中含碳量高于碳酸钠,所以碳酸氢钠产生二氧化碳的物质的量多,则在相同条件下产生CO2的体积V(Na2CO3)小于V(NaHCO3);
(3)加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,设碳酸氢钠的质量为x,则
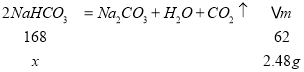
x=168×2.48g÷62=6.72g,
原混合物中碳酸钠的质量为10.00g-6.72g=3.28g,原混合物中碳酸钠的质量分数为
![]() ×100%=32.8%;
×100%=32.8%;
(4)容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,则m(Na2CO3)=cVM=1L×2mol·L-1×106g·mol-1=212g;
故选A;
(5)A、容量瓶实验前用蒸馏水洗干净,但未烘干,无影响,浓度不变,故A错误;
B、定容观察液面时俯视,溶液体积偏小,浓度偏大,故B正确;
C、未冷却至室温就开始定容,体积偏小,浓度偏高,故C正确;
D、加蒸馏水时不慎超过了刻度,溶液体积偏大,浓度偏小,故D错误;
故选:BC.

 阅读快车系列答案
阅读快车系列答案