题目内容
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【答案】C
【解析】
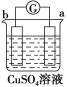 中发生电化学腐蚀,a极质量减小,b极质量增加,a极为负极,b极为正极,所以金属的活动性顺序a>b;
中发生电化学腐蚀,a极质量减小,b极质量增加,a极为负极,b极为正极,所以金属的活动性顺序a>b;
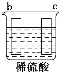 中发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c;
中发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c;
 中发生电化学腐蚀,d极溶解所以d是负极,c极有气体产生所以c是正极,所以金属的活动性顺序d>c;
中发生电化学腐蚀,d极溶解所以d是负极,c极有气体产生所以c是正极,所以金属的活动性顺序d>c;
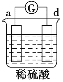 中发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a;
中发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a;
综上所述,这四种金属的活动性顺序d>a>b>c,故选C。

【题目】环境问题已经是我国面临的重大问题.
Ⅰ![]() 减少二氧化碳的排放是一项重要课题.研究表明,
减少二氧化碳的排放是一项重要课题.研究表明,![]() 经催化加氢可合成低碳醇:
经催化加氢可合成低碳醇:![]() 几种化学键的键能如表所示
几种化学键的键能如表所示
化学键 |
|
|
|
|
|
|
键能 | 803 | 436 | 332 | 409 | 463 | 326 |
通过计算得出![]() ______ .
______ .
![]() 在
在![]() 恒容密闭容器中投入
恒容密闭容器中投入![]() 和
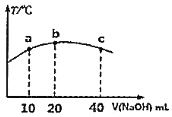
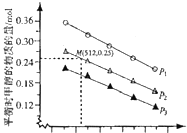
和![]() 发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为![]() ,温度为512K时,向该容器中投入
,温度为512K时,向该容器中投入![]() 、
、![]()
![]() 、2mol
、2mol![]() 、
、![]()
![]() 时,平衡向 ______ 方向移动.
时,平衡向 ______ 方向移动.
![]() 以
以![]() 、空气
、空气![]() 含量
含量![]() 、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解
、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解![]()
![]() 溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
Ⅱ![]() 也是一种大气污染物,可以用海水处理含
也是一种大气污染物,可以用海水处理含![]() 的废气,海水中主要离子的含量如下:
的废气,海水中主要离子的含量如下:
成分 | 含量 | 成分 | 含量 |
| 18980 |
| 400 |
| 10560 |
| 142 |
| 2560 |
| 1272 |
![]() 海水经初步处理后,还含有
海水经初步处理后,还含有![]() 、
、![]() ,
,![]() 、
、![]() ,向其中加入石灰浆使海水中的
,向其中加入石灰浆使海水中的![]() 转换为
转换为![]() ,当
,当![]() 刚好沉淀完全时,
刚好沉淀完全时,![]()
![]() 为 ______
为 ______ ![]()
已知![]()
![]()
![]() 处理过的废气中
处理过的废气中![]() 的含量可以通过碘量法来测定.用到的试剂有:
的含量可以通过碘量法来测定.用到的试剂有:![]() 的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟
的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟![]() 标况下
标况下![]() 的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中
的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中![]() 的含量 ______
的含量 ______ ![]() 用含a,t的式子表示
用含a,t的式子表示![]()
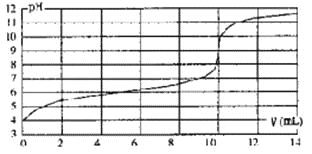
【题目】(一)(1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为________(以K和k逆表示)。若k正= 0.0027min-1,在t=40min时,v正=________min-1。
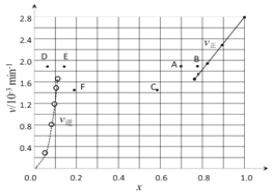
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)。
(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为______________________。