题目内容
【题目】深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________,原因是__________。
③IO3-的中心原子的杂化方式为______。一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)。
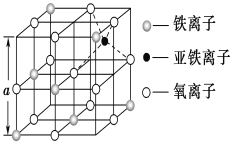
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
【答案】![]() N>O>C 同一周期中,第一电离能呈增大趋势,但N处于VA族,其最外层p能级处于半充满状态,第一电离能反常 sp3
N>O>C 同一周期中,第一电离能呈增大趋势,但N处于VA族,其最外层p能级处于半充满状态,第一电离能反常 sp3 ![]() 、
、![]() 12 5 分子晶体 正八面体
12 5 分子晶体 正八面体 ![]()
【解析】
根据核外电子排布规律书写价电子的轨道排布式;根据第一电离能的概念及全满、半满结构分析比较第一电离能的大小;根据价层电子对数判断中心原子的轨道杂化方式,根据等电子体概念判断等电子体;根据化学键的类型计算微粒中σ键的数目;根据晶胞的结构分析微粒间构成的空间构型,通过密度和体积进行相关计算;根据物质的物理性质分析判断晶体类型。
(1)①铁为26号元素,基态Fe原子核外电子排布式为[Ar]3d64s2,根据泡利不相容原理及洪特规则分析知价电子轨道表示式为:![]() ,故答案为:
,故答案为:![]() ;
;
②同一周期中,第一电离能呈增大趋势,但N处于VA族,其最外层p能级处于半充满状态,第一电离能反常,更稳定些,所以第一电离能更大些,故答案为:N>O>C;同一周期中,第一电离能呈增大趋势,但N处于VA族,其最外层p能级处于半充满状态,第一电离能反常;
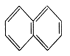
③IO3-价层电子对数=![]() (O原子按不提供电子算),则根据价层电子对互斥理论分析,其中心原子的杂化方式为sp3;等电子体是原子总数相等,价电子总数相等的微粒,故与CN-互为等电子体的分子是CO或N2,它们的电子式为
(O原子按不提供电子算),则根据价层电子对互斥理论分析,其中心原子的杂化方式为sp3;等电子体是原子总数相等,价电子总数相等的微粒,故与CN-互为等电子体的分子是CO或N2,它们的电子式为![]() 、
、![]() ;故答案为:sp3;
;故答案为:sp3;![]() 、
、![]() ;
;
④C原子与N形成叁键,其中1个是σ键,2个是π键,CN-与铁离子之间有6个配位键,所以1molFe(CN)63中含有σ键的数目为12mol,故答案为:12;
(2)Fe原子价电子数为8,CO提供一对孤对电子,与Fe原子形成配位键,则8+2x=18,则x=5;配合物Fe(CO)x的熔沸点比较低,易溶于非极性溶剂,应属于分子晶体,故答案为:5;分子晶体;
(3)如图所示,氧离子处于三价铁离子的前后左右和上下,则构成的空间结构为正八面体,故答案为:正八面体;
(4)FexO晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV可知:![]() ,则x=
,则x=![]() ,故答案为:
,故答案为:![]() 。
。

【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】我国制碱工业的先驱——侯德榜先生发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O→NH4Cl+NaHCO3(晶体)。依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。

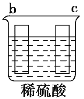
(1)A装置中所发生反应的离子方程式为___。C装置中稀硫酸的作用为___。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水的目的是___。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在___装置与___装置之间(填写字母)连接一个盛有___的洗气装置,其作用是___。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为___。