题目内容
【题目】(一)(1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为________(以K和k逆表示)。若k正= 0.0027min-1,在t=40min时,v正=________min-1。
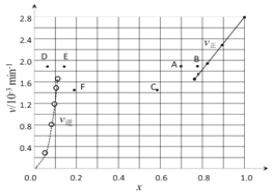
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)。
(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为______________________。
【答案】![]() K正=K K逆 1.95×10-3 A、E 12
K正=K K逆 1.95×10-3 A、E 12
【解析】
(一)(1)①表中第一列,由HI分解建立平衡,表中第二列向逆反应进行建立平衡,由第一列数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸汽物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度计算平衡常数,则平衡常数K=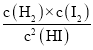 =
=![]() ;
;
②到达平衡时,正、逆反应速率相等,则k正x2(HI)=k逆x(H2)x(I2),则k逆=k正×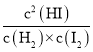 =
=![]() ,即K正=K K逆;在t=40min时,正反应建立平衡的x(HI)=0.85,则v正=k正x2(HI)=0.0027min-1×0.852=1.95×10-3min-1;
,即K正=K K逆;在t=40min时,正反应建立平衡的x(HI)=0.85,则v正=k正x2(HI)=0.0027min-1×0.852=1.95×10-3min-1;
③对于2HI(g) ![]() H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;对于H2(g)+I2(g)
H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;对于H2(g)+I2(g) ![]() 2HI(g)反应建立平衡时:升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,故答案为:A、E;
2HI(g)反应建立平衡时:升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,故答案为:A、E;
(二)200mL0.01molL-1的Ba(OH)2溶液中氢氧化钡物质的量为:0.01molL-1×0.2L=0.002mol,氢氧根的物质的量为0.004mol;100mL0.01molL-1的NaHSO4溶液中硫酸氢钠的物质的量为:0.01molL-1×0.1L=0.001mol,氢离子的物质的量为:0.001mol;两溶液混合后,氢氧根离子过量,溶液显示碱性,反应后的溶液中氢氧根离子浓度为:![]() =0.01mol/L,则溶液的pH=12。
=0.01mol/L,则溶液的pH=12。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。

①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
【题目】现有A、B、X、Y、Z五种短周期元素,原子序数逐渐增大。它们的性质或原子结构如表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素(除稀有气体外) |
Z | 最高正化合价与最低负化合物的代数和为6 |
(1)X的元素名称及在元素周期表中的位置:___、___。
(2)B、X、Y的原子半径由大到小的顺序为(用元素符号表示)___。
(3)W元素的核电荷数是B、X的核电荷数的和,则W与Z的氢化物稳定性为___>___(填化学式)。
(4)A、X两元素形成的原子个数比为2:1的化合物属于___晶体,写出该晶体与Z元素形成的单质反应的化学方程式___。