题目内容
【题目】若往![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______![]() 填序号
填序号![]() 。
。
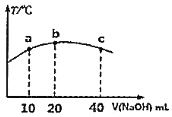
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 该烧碱溶液的浓度为
该烧碱溶液的浓度为![]()
![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点
点
![]() 从b点到c点,混合溶液中一直存在:
从b点到c点,混合溶液中一直存在:![]()
【答案】![]()
【解析】
![]() 是弱酸,弱酸电离是吸热过程,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,则b点恰好完全反应,据此计算该烧碱溶液的浓度;
是弱酸,弱酸电离是吸热过程,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,则b点恰好完全反应,据此计算该烧碱溶液的浓度;
![]() 根据
根据![]() 分析计算该烧碱溶液的浓度;
分析计算该烧碱溶液的浓度;
![]() 电离吸热,温度越高电离平衡常数越大;
电离吸热,温度越高电离平衡常数越大;
![]() 从b点到c点,当
从b点到c点,当![]() 较大时,可能出现:
较大时,可能出现:![]() 。
。
![]() 是弱酸,弱酸电离是吸热过程,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,则b点恰好完全反应,
是弱酸,弱酸电离是吸热过程,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,则b点恰好完全反应,![]() ,故
,故![]() 错误,
错误,
![]() 根据
根据![]() 可知,该烧碱溶液的浓度为
可知,该烧碱溶液的浓度为![]() ,故
,故![]() 正确;
正确;
![]() 电离吸热,温度越高电离平衡常数越大,所以
电离吸热,温度越高电离平衡常数越大,所以![]() 的电离平衡常数:b点
的电离平衡常数:b点![]() 点,故
点,故![]() 正确;
正确;
![]() 从b点到c点,当
从b点到c点,当![]() 较大时,可能出现:
较大时,可能出现:![]() ,故
,故![]() 错误;
错误;
故答案为:![]() 。
。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的价电子排布图为______________________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。B中存在的化学键类型是______;
A.离子键 B.共价键 C.金属键 D.氢键
A分子中碳原子的轨道杂化类型是___________。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出生成配离子的结构______________(要求画出配位键)。
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c