题目内容
【题目】环境问题已经是我国面临的重大问题.
Ⅰ![]() 减少二氧化碳的排放是一项重要课题.研究表明,
减少二氧化碳的排放是一项重要课题.研究表明,![]() 经催化加氢可合成低碳醇:
经催化加氢可合成低碳醇:![]() 几种化学键的键能如表所示
几种化学键的键能如表所示
化学键 |
|
|
|
|
|
|
键能 | 803 | 436 | 332 | 409 | 463 | 326 |
通过计算得出![]() ______ .
______ .
![]() 在
在![]() 恒容密闭容器中投入
恒容密闭容器中投入![]() 和
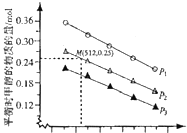
和![]() 发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为![]() ,温度为512K时,向该容器中投入
,温度为512K时,向该容器中投入![]() 、
、![]()
![]() 、2mol
、2mol![]() 、
、![]()
![]() 时,平衡向 ______ 方向移动.
时,平衡向 ______ 方向移动.
![]() 以
以![]() 、空气
、空气![]() 含量
含量![]() 、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解
、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ______ ;用该电池电解![]()
![]() 溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量 ______ .
Ⅱ![]() 也是一种大气污染物,可以用海水处理含
也是一种大气污染物,可以用海水处理含![]() 的废气,海水中主要离子的含量如下:
的废气,海水中主要离子的含量如下:
成分 | 含量 | 成分 | 含量 |
| 18980 |
| 400 |
| 10560 |
| 142 |
| 2560 |
| 1272 |
![]() 海水经初步处理后,还含有
海水经初步处理后,还含有![]() 、
、![]() ,
,![]() 、
、![]() ,向其中加入石灰浆使海水中的
,向其中加入石灰浆使海水中的![]() 转换为
转换为![]() ,当
,当![]() 刚好沉淀完全时,
刚好沉淀完全时,![]()
![]() 为 ______
为 ______ ![]()
已知![]()
![]()
![]() 处理过的废气中
处理过的废气中![]() 的含量可以通过碘量法来测定.用到的试剂有:
的含量可以通过碘量法来测定.用到的试剂有:![]() 的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟
的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟![]() 标况下
标况下![]() 的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中
的流速通入到100mL含有淀粉的碘标准液中,tmin达到滴定终点.滴定终点的现象为 ______ 计算该处理气中![]() 的含量 ______
的含量 ______ ![]() 用含a,t的式子表示
用含a,t的式子表示![]()
【答案】![]() 逆反应
逆反应 ![]() 1mol
1mol ![]() 溶液蓝色褪去,且半分钟不恢复颜色
溶液蓝色褪去,且半分钟不恢复颜色 ![]()
【解析】
![]() 焓变等于反应物总键能减去生成物总键能,据此进行计算;
焓变等于反应物总键能减去生成物总键能,据此进行计算;
(2)根据三段式进行分析计算平衡常数;根据浓度商与平衡常数的关系,判断反应进行的方向;
![]() 甲醇作为原电池的负极。发生氧化反应;根据电子得失守恒进行电解硫酸铜溶液中两极产生气体的总量计算;
甲醇作为原电池的负极。发生氧化反应;根据电子得失守恒进行电解硫酸铜溶液中两极产生气体的总量计算;
Ⅱ![]() 刚好沉淀完全时,溶液中
刚好沉淀完全时,溶液中![]() ,根据KSP=c(Mg2+)×c2(OH-)进行计算出c(OH-),再根据KSP=c(Ca2+)×c2(OH-)进行计算出c(Ca2+);
,根据KSP=c(Mg2+)×c2(OH-)进行计算出c(OH-),再根据KSP=c(Ca2+)×c2(OH-)进行计算出c(Ca2+);
![]() 根据发生反应:
根据发生反应:![]() 来确定滴定终点时溶液颜色的变化;根据反应关系计算出二氧化硫的体积。
来确定滴定终点时溶液颜色的变化;根据反应关系计算出二氧化硫的体积。
![]() 焓变等于反应物总键能减去生成物总键能,则
焓变等于反应物总键能减去生成物总键能,则![]() 的
的![]() ,
,
故答案为:![]() ;
;
![]() 当压强为
当压强为![]() ,温度为512K时,平衡时甲醇为
,温度为512K时,平衡时甲醇为![]() ,则:
,则:
![]()
起始量![]() :1
:1 ![]() 00
00
变化量![]() :
:![]()
![]()
![]()
![]()
平衡量![]() :
:![]() 2
2 ![]()
![]()
由于容器的容积为1L,利用物质的量代替浓度计算平衡常数,故平衡常数![]() ,
,
此时浓度商![]() ,反应向逆反应进行,
,反应向逆反应进行,
故答案为:逆反应;
![]() 原电池负极发生氧化反应,负极上是甲醇失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:
原电池负极发生氧化反应,负极上是甲醇失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:![]()
硫酸铜物质的量为![]() ,铜离子完全放电获得电子为
,铜离子完全放电获得电子为![]() ,56L空气中氧气物质的量为
,56L空气中氧气物质的量为![]() ,转移电子为
,转移电子为![]() ,故阴极氢离子还放电,根据电子转移守恒,生成氢气的物质的量为
,故阴极氢离子还放电,根据电子转移守恒,生成氢气的物质的量为![]() ,阳极是氢氧根离子放电生成氧气,由电子转移守恒可知生成氧气为
,阳极是氢氧根离子放电生成氧气,由电子转移守恒可知生成氧气为![]() ,故两极生成气体总物质的量为
,故两极生成气体总物质的量为![]() ,
,
故答案为:![]() ;1mol;
;1mol;
Ⅱ![]() 刚好沉淀完全时,溶液中
刚好沉淀完全时,溶液中![]() ,
,![]() ,
,![]() ,联立可得
,联立可得![]() ,
,
故答案为:![]() ;
;
![]() 发生反应:
发生反应:![]() ,滴定终点时,溶液蓝色褪去,且半分钟不恢复颜色;通入气体总体积为taL,由方程式可知
,滴定终点时,溶液蓝色褪去,且半分钟不恢复颜色;通入气体总体积为taL,由方程式可知![]() ,则
,则![]() ,该处理气中
,该处理气中![]() 的含量
的含量![]() ;
;
故答案为:溶液蓝色褪去,且半分钟不恢复颜色;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的价电子排布图为______________________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。B中存在的化学键类型是______;
A.离子键 B.共价键 C.金属键 D.氢键
A分子中碳原子的轨道杂化类型是___________。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出生成配离子的结构______________(要求画出配位键)。
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流计指示,导线中电流从a极流向d极 |
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c