题目内容
9.下列说法正确的是( )| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
分析 A、稀释醋酸时能促进弱电解质醋酸的电离,导致稀释后溶液中氢离子浓度大于原来的$\frac{1}{10}$;
B、NaOH滴定HCl与CH3COOH,醋酸是弱电解质,若碱与酸恰好反应,溶液中溶质为氯化钠、醋酸钠,醋酸根水解溶液呈碱性,反应呈中性,溶液中的酸有剩余;
C、氢原子转化为氢分子,形成化学键放出能量,可据此判断能量的大小;
D、氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,溶液中c(Cl-)越大,c(Ag+)越小.
解答 解:A、稀释醋酸时能促进弱电解质醋酸的电离,导致稀释后溶液中氢离子浓度大于原来的$\frac{1}{10}$,稀释后溶液的3<pH<4,故A错误;
B、NaOH滴定HCl与CH3COOH,醋酸是弱电解质,若碱与酸恰好反应,溶液中溶质为氯化钠、醋酸钠,醋酸根水解溶液呈碱性,反应呈中性,溶液中的酸有剩余,故B正确;
C、氢原子转化为氢分子,形成化学键放出能量,说明2mol氢原子的能量大于1molH2,故C错误;
D、氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,①蒸馏水中没有氯离子、②0.1mol/L盐酸中c(Cl-)=0.1mol/L,③0.1 mol/L氯化镁溶液c(Cl-)=0.2mol/L、④0.1mol/L硝酸银溶液中c(Ag+)=0.1mol/L,溶液中c(Ag+)为④>①>②>③,故D错误;
故选B.
点评 考查化学反应中的能量变化、弱电解质的电离、盐类水解、溶度积及相关计算等,难度中等,注意把握强弱电解质关键是电解质是否完全电离.

练习册系列答案
相关题目
1.下列微粒中,所有原子都满足最外层为8电子结构的是( )
| A. | 碳正离子[(CH3)3C+] | B. | PCl3 | C. | 尿素( ) ) | D. | HClO |
4.某有机物T的分子式为C5H12O4,0.1mol T与足量钠反应生成4.48L(标准状况)氢气.已知一个碳原子上连接两个-OH的有机物不稳定.则T的稳定结构(不考虑立体异构)有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
14.已知25℃时有关弱酸的电离平衡常数如下表:
下列推断正确的是( )
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | HX、HY两种弱酸的酸性:HX<HY | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:CO32->Y->X->HCO3- | |
| D. | HX与Na2CO3反应,无气泡产生 |
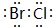 ,属于分子晶体(填晶体类型).
,属于分子晶体(填晶体类型).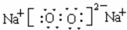 .
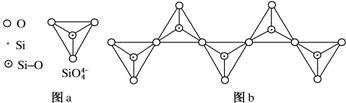
.


 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)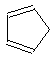 ,E的结构简式是CH3CHO.
,E的结构简式是CH3CHO.
 .
.