题目内容
1.下列微粒中,所有原子都满足最外层为8电子结构的是( )| A. | 碳正离子[(CH3)3C+] | B. | PCl3 | C. | 尿素( ) ) | D. | HClO |
分析 在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足,以此来解答.
解答 解:A.该反应中含有氢原子,其最外层族序数+成键数=1+1=2,有一个碳也不满足8个电子,所以不能满足所有原子最外层8电子结构,故A错误;
B.PCl3中,P原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故B正确;
C.该反应中含有氢原子,其最外层族序数+成键数=1+1=2,所以不能满足所有原子最外层8电子结构,故C错误;
D.该反应中含有氢原子,其最外层族序数+成键数=1+1=2,所以不能满足所有原子最外层8电子结构,故D错误;
故选B.
点评 本题考查了8电子稳定结构,明确元素的位置、最外层电子数、成键数即可判断,除此之外还可以根据“元素化合价的绝对值+最外层电子数=8”判断,难度中等.

练习册系列答案
相关题目
14.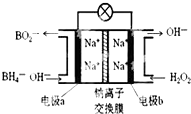 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
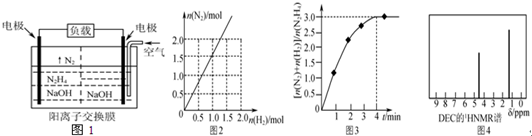
12.文献报道某课题组利用CO2催化氢化制甲烷的研究过程如图1:
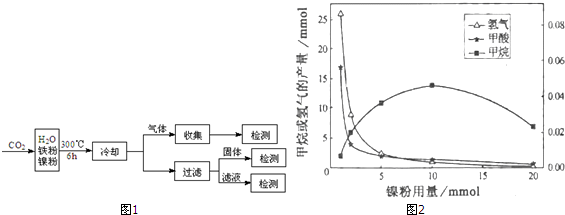
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图2所示(仅改变镍粉用量,其他条件不变):研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:CO2$\stackrel{Ⅰ}{→}$HCOOH$\stackrel{Ⅱ}{→}$CH4.由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4.CH4、HCOOH、H2的产量和镍粉用量的关系如图2所示(仅改变镍粉用量,其他条件不变):研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:CO2$\stackrel{Ⅰ}{→}$HCOOH$\stackrel{Ⅱ}{→}$CH4.由图可知,镍粉是反应Ⅰ、Ⅱ的催化剂,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )
| A. | 反应Ⅰ的速率增加,反应Ⅱ的速率不变 | |
| B. | 反应Ⅰ的速率不变,反应Ⅱ的速率增加 | |
| C. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 | |
| D. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 |
9.下列说法正确的是( )
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
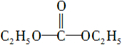 .
.
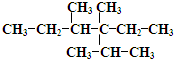 2,3,4-三甲基-3-乙基己烷
2,3,4-三甲基-3-乙基己烷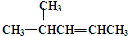 4-甲基-2-戊烯
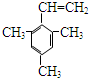
4-甲基-2-戊烯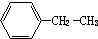 乙苯
乙苯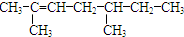
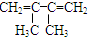
 .
.

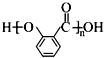 ;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应.
;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应.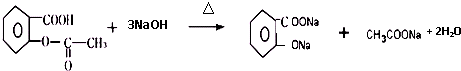 .
.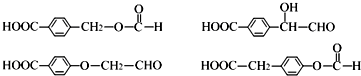 .
. )合成2-甲基-3-甲酸甲酯吲哚的反应方程式
)合成2-甲基-3-甲酸甲酯吲哚的反应方程式 .
.