题目内容
18.甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.I:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ•mol-1
II:CO(g)+2H2(g)=CH3OH (g)△H=-129.0kJ•mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H=+77.0kJ•mol-1.
分析 Ⅰ、CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol
Ⅱ、CO(g)+2 H2(g)=CH3OH(g)△H=-129.0 kJ/mol
根据盖斯定律将方程式Ⅰ+Ⅱ计算得到;
解答 解:Ⅰ、CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol
Ⅱ、CO(g)+2 H2(g)=CH3OH(g)△H=-129.0 kJ/mol
将方程式Ⅰ+Ⅱ得CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+206.0kJ/mol+(-129.0kJ/mol)=+77.0 kJ/mol,
故答案为:+77.0 kJ•mol-1;
点评 本题考查了盖斯定律,根据盖斯定律书写热化学方程式,难度不大.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
9.下列说法正确的是( )
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
3.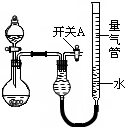 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
请回答下列问题:
(1)Cu与稀HNO3反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?不可行(可行、不可行),请简述原因因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准.
(3)实验②、③中,量气管中的液体最好分别是A、C.(只选一种)
A.CCl4 B.H2OC.饱和NaHCO3溶 D.液饱和Na2CO3溶液
(4)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②使量气管两端液面相,③视线与凹液面最低处相平.
(5)实验④用于测定合金中铝的质量分数,获得以下数据(气体体积均已换算成标准状况)
根据上述合理数据计算镁铝合金中铝的质量分数27%.
 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | H2O | |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(1)Cu与稀HNO3反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?不可行(可行、不可行),请简述原因因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准.
(3)实验②、③中,量气管中的液体最好分别是A、C.(只选一种)
A.CCl4 B.H2OC.饱和NaHCO3溶 D.液饱和Na2CO3溶液
(4)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②使量气管两端液面相,③视线与凹液面最低处相平.
(5)实验④用于测定合金中铝的质量分数,获得以下数据(气体体积均已换算成标准状况)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 10.0mL | 347.5mL |
| 2 | 1.0g | 10.0mL | 335.0mL |
| 3 | 1.0g | 10.0mL | 344.5mL |
6.下列说法正确的是( )
| A. | 该  有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. |  该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该有机物 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol |



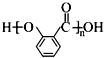 ;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应.
;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应.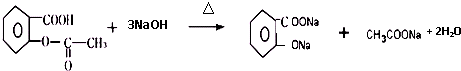 .
.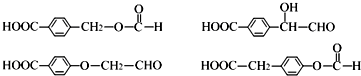 .
. )合成2-甲基-3-甲酸甲酯吲哚的反应方程式
)合成2-甲基-3-甲酸甲酯吲哚的反应方程式 .
.