题目内容
9.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1 mol甲基的电子数目为10NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
分析 A.标准状况下,戊烷的状态不是气体;
B.乙烯分子中含有4个碳氢键、1个碳碳双键,总共含有6个共用电子对;
C.甲基中含有9个电子,1mol甲基中含有9mol电子;
D.三者的最简式为CH2,根据最简式计算出14g混合气体中含有的原子数.
解答 解:A.标况下戊烷不是气体,不能使用标况下的气体摩尔体积计算11.2L戊烷的物质的量,故A错误;
B.28g乙烯的物质的量为1mol,1mol乙烯分子中含有4mol碳氢键、1mol碳碳双键,总共含有6mol共用电子对,含共用电子对数目为6NA,故B错误;
C.甲基为中性原子团,1mol甲基中含有9mol电子,含有的电子数目为9NA,故C错误;
D.乙烯、丙烯、丁烯的最简式为CH2,14g混合物中含有14g最简式CH2,含有1molCH2,则含有3mol原子,原子数为3NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,明确标况下气体摩尔体积的使用条件,还要明确甲基与甲烷、羟基与氢氧根离子的区别,为易错点.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
19.某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙.倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙.过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成.下列所得结论不正确的是( )
| A. | 铜与浓硫酸反应所得白色固体甲是CuSO4 | |
| B. | 加BaCl2溶液后所得白色沉淀是BaSO3 | |
| C. | 白色固体甲中夹杂的少量黑色物质乙中不可能含有CuO | |
| D. | 白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S |
20.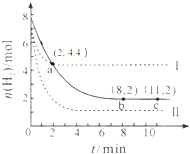 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 曲线Ⅰ对应的条件改变可能降低温度 | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 该温度下,此反应的化学平衡常数的数值为0.5 | |
| D. | 从反应开始至a 点,ν(CO2)=0.6 mol•L-1•min-1 |
17.下列说法正确的是( )
| A. | 同一周期中的第ⅡA族和第ⅢA族元素的原子序数差一定为1 | |
| B. | L层上的电子数为奇数的元素一定是主族元素 | |
| C. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| D. | 族序数等于周期序数的元素一定是金属元素 |
4.反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2.
下列说法正确的是( )
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2.
下列说法正确的是( )
| A. | 两个反应中均为硫元素被氧化 | |
| B. | 反应①、②中生成等量的I2时转移电子数比为1:5 | |
| C. | 氧化性:MnO2>SO42->IO3->I2 | |
| D. | 碘元素在反应①中被还原,在反应②中被氧化 |
16.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含离子数约为1.806×1024 | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | N2H4分子中极性键和非极性键的比值为1:4 |
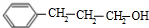 +
+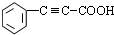 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$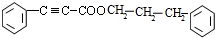 +H2O.
+H2O.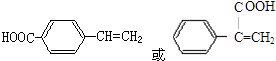 .
.