题目内容
18.(1)质量相同的H2O和D2O所含质子数之比为10:9,中子数之比为8:9,分别与足量的金属钠反应生成气体在同温同压下体积之比为10:9.(2)将32,64克铜与140毫升一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11200毫升,则混合气体中NO的体积是5824毫升; NO2的体积为5376毫升.
分析 (1)质量相同的H2O和D2O点的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,所以质子数之比为10:9,中子数之比为10×8:9×10=8:9,由化学方程式知气体体积之比等于水的物质的量之比;
(2)根据氧化还原反应转移的电子的物质的量守恒,结合气体的总体积列式计算.
解答 解:(1)质量相同的H2O和D2O点的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,所以质子数之比为10:9,中子数之比为10×8:9×10=8:9,由化学方程式知气体体积之比等于水的物质的量之比,即为:10:9;故答案为:10:9; 8:9;10:9;
(2)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,
11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
设混合气体中含有xmolNO,ymolNO2,
则$\left\{\begin{array}{l}{x+y=0.5(质量守恒)}\\{3x+y=1.02(电子守恒)}\end{array}\right.$
解之得:$\left\{\begin{array}{l}{x=0.26}\\{y=0.24}\end{array}\right.$
混合气体中NO的体积是0.26×22.4=5824毫升; NO2的体积为5376毫升,故答案为:5824; 5376.
点评 本题考查化学方程式的计算,题目难度不大,注意从守恒的角度解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图,则下列说法中正确的是( )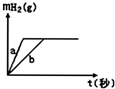

| A. | 曲线a为K,b为Na | B. | 投入的Na的质量大于K的质量 | ||
| C. | 投入的Na、K一定等质量 | D. | 稀盐酸的量一定是不足量的 |
12.某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
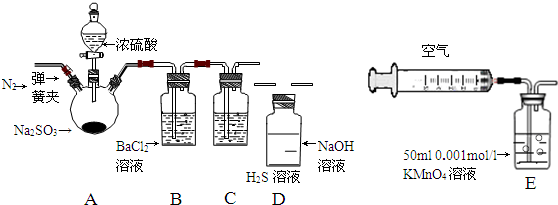
(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
(7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)$\frac{2.8}{V}$.

(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |
9.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1 mol甲基的电子数目为10NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
13.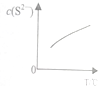 硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )
硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )
 硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )
硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )| A. | 反应(x-1)S(s)+S2-(aq)?Sx2-(aq)的△H>0 | |
| B. | 该反应的平衡常数随温度的升高而减小 | |
| C. | 其他条件不变时,向平衡后的溶液中再加入硫粉,可使溶液中c(Sx2-)增大 | |
| D. | 依此原理,常温下Cl2在饱和NaCl溶液中的溶解度也比在水中的大 |
3.某非金属元素X的最高化合价为+m,其最高价氧化物的水化物的分子中有b个氧原子,则该元素氢化物的分子式为( )
| A. | Hm+2bX | B. | Hm-2bX | C. | Hm-8X | D. | H8-mX |
10.下列两个反应的类型相同的是( )
| A. | 由乙炔制氯乙烯;甲烷与氯气在光照条件下反应 | |
| B. | 溴乙烷和氢氧化钠乙醇溶液共热;乙醇制得乙烯 | |
| C. | 乙烯使溴的四氯化碳溶液褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 溴乙烷和氢氧化钠溶液共热;乙烯和氢气反应 |
7.C5H12有3种不同结构:甲CH3(CH2)3CH3,乙CH3CH(CH3)CH2CH3,丙C(CH3)4.下列相关叙述正确的是( )
| A. | 甲、乙、丙属同系物均可与氯气、溴蒸气发生取代反应 | |
| B. | C5H12表示一种纯净物 | |
| C. | 甲、乙、丙中,丙的沸点最低 | |
| D. | 乙有3种不同沸点的二氯取代物 |
8.钢铁生锈过程发生如下反应:下列说法正确的是( )
①2Fe+O2+2H2O═2Fe(OH)2;
②4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③2Fe(OH)3═Fe2O3+3H2O.
①2Fe+O2+2H2O═2Fe(OH)2;
②4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③2Fe(OH)3═Fe2O3+3H2O.
| A. | 当参加反应的O2等物质的量时,反应①、②中电子转移数目相等 | |
| B. | 反应①中氧化剂是氧气和水 | |
| C. | 与铜质水龙头连接处的钢质水管不易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中不能发生电化学腐蚀 |