题目内容
16.元素电负性随原子序数的递增而增强的是( )| A. | Na、K、Rb | B. | N、P、As | C. | Si、P、Cl | D. | O、S、Cl |
分析 电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角(零族元素除外);同周期自左而右电负性增大,同主族自上而下电负性降低,非金属性越强电负性越强,故金属性越强电负性越小.
解答 解:A.电负性:Na>K>Rb,故A错误;
B.电负性:N>P>As,故B错误;
C.电负性:Cl>P>Si,故C正确;
D.电负性:O>S,Cl>S,故D错误.
故选C.
点评 本题考查电负性及与金属性非金属性的关系等,难度中等,清楚主族元素电负性的递变规律是解题关键.

练习册系列答案
相关题目
6.已知:
C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O=O键能分别为436、496kJ•mol-1,则O-H键能为( )
C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O=O键能分别为436、496kJ•mol-1,则O-H键能为( )
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
7.对室温下100mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )


| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
4.下列有关化学用语的表述错误的是( )
| A. | Ca2+的结构示意图为: | |
| B. | 氯仿的化学式:CHCl3 | |
| C. | R2+离子核外有a个电子,b个中子,R原子表示为a+ba+b+2R | |
| D. | 溴化氢分子的电子式: |
11.以下各分子中,所有原子都满足最外层8电子稳定结构的是( )
| A. | NO2 | B. | BF3 | C. | PCl3 | D. | H3O+ |
8.下列反应中有机物被氧化的是( )
| A. | 葡萄糖发生银镜反应 | B. | 乙醛制乙醇 | ||
| C. | 乙醇制乙烯 | D. | 乙酸和碳酸钠反应 |
5.“喷水溶液法”是最近日本科学家研究出的一种使沙漠变绿洲的新技术,它是在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土结合,在地表下30-50cm处形成0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水作用.下列对聚丙烯酸酯说法不正确的是( )
| A. | 形成它的小分子结构简式为CH2=CHCOOR(R为烃基) | |
| B. | 在一定条件下能发生加成反应 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 没有固定的熔沸点 |

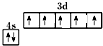 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.