题目内容
6.已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O=O键能分别为436、496kJ•mol-1,则O-H键能为( )
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
分析 根据盖斯定律计算水分解反应的焓变,化学反应的焓变△H=反应物的键能之和-生成物键能之和进行计算.
解答 解:已知①C(s)+H2O(g)═CO(g)+H2(g)△H=+130kJ•mol-1,
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(2×130+220)kJ•mol-1=480kJ•mol-1,
设O-H键能为akJ•mol-1,则4a-496-2×436=480,
解得a=462.
故选C.
点评 本题考查学生盖斯定律的应用以及化学反应的能量和化学键键能之间的关系,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
相关题目
16.下列叙述错误的是( )
| A. | 阴、阳离子通过静电吸引所形成的化学键,叫离子键 | |
| B. | 活泼金属元素与活泼非金属元素化合时,形成的是离子键 | |
| C. | 某元素最外层只有一个电子,它与卤素原子结合时所形成的化学键不一定是离子键 | |
| D. | 全部由非金属元素组成的化合物可能是离子化合物 |
17. A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
(1)A在元素周期表中的位置是第3周期ⅡA族;A与E形成的化合物的电子式是 .
.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
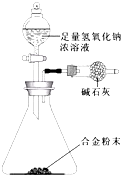
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
 A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
 .
.(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
1.工业上以铝土矿(主要成分是Al2O3,含杂质Fe2O3和SiO2)为原料生产铝,其生产流程如下:
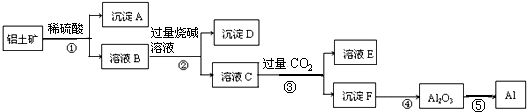
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 沉淀A主要是SiO2 | B. | 步骤②的目的是分离Fe3+和Al3+ | ||
| C. | 溶液E溶质主要有碳酸钠和硫酸钠 | D. | ⑤主要是把电能转化为化学能 |
11.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| C. | 0.10mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 54g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
18.下列有关Na2CO3和NaHCO3的说法,错误的是( )
| A. | 都易溶于水 | B. | 水溶液都显碱性 | C. | 都能与盐酸反应 | D. | 加热都能分解 |
15.下列说法中,正确的是( )
| A. | 氧气和臭氧互为同分异构体 | B. | 二氧化碳晶体中存在分子间作用力 | ||
| C. | 1H2O和2H2O互为同位素 | D. | 正丁烷和异丁烷互为同系物 |
16.元素电负性随原子序数的递增而增强的是( )
| A. | Na、K、Rb | B. | N、P、As | C. | Si、P、Cl | D. | O、S、Cl |
 将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: