题目内容
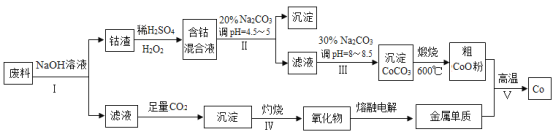
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步操作采取的分离方法是___。
(2)根据上述框图反应关系,写出下列B、C、E所含物质的化学式
沉淀固体B___;C___;E___
(3)写出①、④四个反应方程式(是离子反应的写离子方程式)
①___;④___。
【答案】过滤 Al2O3 Al2O3,Fe2O3 K2SO4、(NH4)2SO4 Al2O3+2OH-=2AlO2-+H2O 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
混合物A含有KAl(SO4)2、Al2O3和Fe2O3,KAl(SO4)2可溶于水,加水过滤时,沉淀C为Al2O3和Fe2O3,溶液中的溶质为KAl(SO4)2;沉淀C中,Al2O3可与NaOH反应生成偏铝酸钠溶液,操作III为过滤,可得到Fe2O3沉淀和偏铝酸钠、NaOH的混合液;加入适量的盐酸可得到氢氧化铝沉淀和氯化钠溶液,氢氧化铝加热得到氧化铝,则固体B为氧化铝;硫酸铝钾溶液通入过量的氨水得到氢氧化铝沉淀和硫酸钾铵溶液。
(1)根据流程可知,操作I、II、III、IV四步操作采取的分离方法均为过滤;
(2)固体B为氧化铝,化学式为Al2O3;沉淀C为Al2O3、Fe2O3混合物;E为硫酸钾和硫酸铵的混合物;
(3)反应为氧化铝与NaOH反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O;反应为氢氧化铝受热分解生成氧化铝和水,化学方程式为2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目