题目内容
【题目】(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2d.CO2
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:__________
(3)工业生产甲醇的常用方法是:CO(g)+2H2(g)![]() CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H =________。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
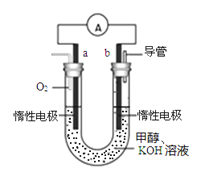
①该电池工作时,负极是_______极(填“a”或 “b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为_________________。
(5)电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s)+4HCl(aq)![]() 2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+ 2H2O(l) △H =-49.04 kJ·mol-1
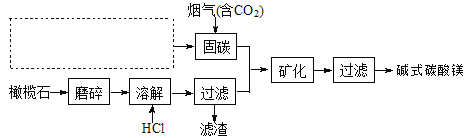
①某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为_____________。
②在上图虚框内补充一步工业生产流程______________。
③经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是__________。
【答案】b 4KClO3![]() KCl+3KClO4 -1527.6kJ /mol b CH3OH+8OH-—6e-=CO32-+6H2O 9MgO·FeO·5SiO2
KCl+3KClO4 -1527.6kJ /mol b CH3OH+8OH-—6e-=CO32-+6H2O 9MgO·FeO·5SiO2 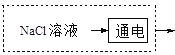 或
或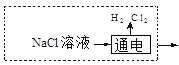 取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净
取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净
【解析】
(1)根据四种气体的酸碱性以及氧化还原性分析。
(2)根据原子守恒和电子守恒分析生成物,然后配平。
(3)根据盖斯定律计算△H。
(4)燃料电池的负极是通燃料的一极,在碱性环境下写负极的电极反应式。
(5)硅酸盐写成氧化物的形式,按照先活泼金属氧化物后不活泼氧化物,后二氧化硅顺序写;固定二氧化碳可以用碱,工业上制取NaOH的方法是电解法;判断产品洗净的原理是检验固体上可能附着的离子。
(1)a、氨气是碱性气体,不能用五氧化二磷干燥;b、碘化氢是酸性气体,有还原性,不能用浓硫酸干燥,能用五氧化二磷干燥,正确;c、二氧化硫能用浓硫酸和五氧化二磷干燥,错误;d、二氧化碳能用浓硫酸或五氧化二磷干燥。所以选b。
(2)氯酸钾中的氯为+5价,产物中一种是无氧酸盐,可为氯化钾,氯元素化合价降低,所以还有氯元素化合价升高,生成高氯酸钾,所以方程式为:4KClO3![]() KCl+3KClO4。
KCl+3KClO4。
(3)根据盖斯定律分析,方程式③-①×2+②×2即可,反应热=-566+90.8×2-571.6×2= -1527.6kJ /mol。
(4)① 燃料电池中燃料做负极,所以b为负极。② 甲醇在碱性条件下失去电子生成碳酸根离子,电极反应为:CH3OH+8OH-—6e-=CO32-+6H2O。
(5)①根据硅酸盐改写成氧化物的形式,先活泼金属氧化物后不活泼氧化物,后二氧化硅,所以氧化物的形式表示为: 9MgO·FeO·5SiO2。
②从固碳的反应可以看出需要用氢氧化钠溶液,所以图框内补充得到氢氧化钠一步工业生产流程即可,可能通过电解饱和的氯化钠溶液, 或
或
③判断产品是否洗净是需要检查最后一次的洗涤液是否含有氯离子,所以操作为取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净。