题目内容
【题目】在一定温度下、一定体积条件下,能说明下列反应达到平衡状态的是
A.反应2SO2(g)+O2(g)![]() 2SO3(g) 容器内的密度不随时间变化
2SO3(g) 容器内的密度不随时间变化
B.反应A2(g)+B2(g)![]() 2AB(g)容器内A2的消耗速率与AB消耗速率相等
2AB(g)容器内A2的消耗速率与AB消耗速率相等
C.反应N2+3H2![]() 2NH3容器内气体平均相对分子质量不随时间变化
2NH3容器内气体平均相对分子质量不随时间变化
D.反应4A(s)+3B(g)![]() 2C(g)+D(g)容器内气体总压强不随时间变化
2C(g)+D(g)容器内气体总压强不随时间变化
【答案】C
【解析】
试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A.密度=混合气的质量÷容器容积,在反应过程中质量和容积始终是不变的,不能说明反应达到平衡状态;B.A2的消耗速率与AB消耗速率相等,不能说明反应达到平衡状态,故B错误;C.混合气的平均相对分子质量=混合气体的质量÷混合气体的总的物质的量,C中质量不变,但物质的量是变化的,当容器内气体平均相对分子质量不随时间变化时,说明反应达到平衡状态,故C正确;D.反应前后气体体积是不变的,所以压强也是始终不变的,不能说明反应达到平衡状态,故D错误;故选C。

 应用题作业本系列答案
应用题作业本系列答案【题目】【2016江苏卷】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 SO32–的强 |
【题目】下表各组物质中,物质之间不可能实现如图![]() 所示转化的是( )
所示转化的是( )
选项 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
A. A B. B C. C D. D
【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
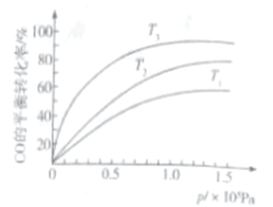
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。