题目内容
【题目】将5 g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入2mol/L的盐酸,当加入盐酸的体积为45mL时产生CO2的体积为896 mL(标准状况),之后再加入盐酸不再产生CO2。
(1)当加入40 mL盐酸时,产生二氧化碳的体积为_________mL;(标准状况)
(2)计算原混合物中Na2CO3的质量分数为____________;
(3)请在右图中绘制出加入盐酸体积与产生CO2体积的关系曲线。(要在纵坐标上标明标准状况下CO2体积的数值)____________
【答案】 672 42.4﹪ 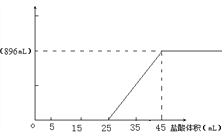
【解析】试题分析:逐滴加入2mol/L的盐酸45mL时产生CO2的体积最大为896 mL,则可知混合物中碳元素的物质的量为0.04 mol,钠元素的物质的量为2mol/L×0.045L=0.09 mol,在溶液中只含氢氧化钠和碳酸钠两种溶质,根据元素守恒可计算溶液中氢氧化钠、碳酸钠的物质的量;滴加盐酸依次发生H++OH- ═H2O、CO32-+H+═HCO3-、HCO3-+H+═CO2↑+H2O三个反应。
(3)根据元素守恒可及三种物质的总质量来计算原混合物中碳酸钠的质量。
解析:设溶液中氢氧化钠、碳酸钠的物质的量分别为xmol、ymol
根据元素守恒, 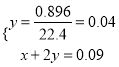 ,解得x=0.01mol,滴加盐酸依次发生H++OH- ═H2O、CO32-+H+═HCO3-、HCO3-+H+═CO2↑+H2O三个反应,H++OH- ═H2O反应消耗盐酸
,解得x=0.01mol,滴加盐酸依次发生H++OH- ═H2O、CO32-+H+═HCO3-、HCO3-+H+═CO2↑+H2O三个反应,H++OH- ═H2O反应消耗盐酸![]() 5mL; CO32-+H+═HCO3-反应消耗盐酸
5mL; CO32-+H+═HCO3-反应消耗盐酸![]() 20mL;
20mL;
HCO3-+H+═CO2↑+H2O反应消耗盐酸![]() 20mL;根据分析,当加入40 mL盐酸时,HCO3-+H+═CO2↑+H2O反应只消耗15mL的盐酸,产生二氧化碳的体积为
20mL;根据分析,当加入40 mL盐酸时,HCO3-+H+═CO2↑+H2O反应只消耗15mL的盐酸,产生二氧化碳的体积为![]() 0.672 L=672mL; (2)根据水溶液中只含氢氧化钠和碳酸钠,说明原混合物溶于水时碳酸氢钠与氢氧化钠完成反应生成碳酸钠后,剩余0.01mol氢氧化钠,根据HCO3-+OH-═CO32-+H2O,设原混合物中计算原混合物中碳酸氢钠的物质的量为a mol,Na2CO3的物质的量为bmol,则氢氧化钠的物质的量为a+0.01 mol;根据钠元素守恒a+ a+0.01+2b=0.09;根据质量守恒84a+40(a+0.01)+106b=5,b=0.02mol,a=0.02mol,原混合物中Na2CO3的质量分数为
0.672 L=672mL; (2)根据水溶液中只含氢氧化钠和碳酸钠,说明原混合物溶于水时碳酸氢钠与氢氧化钠完成反应生成碳酸钠后,剩余0.01mol氢氧化钠,根据HCO3-+OH-═CO32-+H2O,设原混合物中计算原混合物中碳酸氢钠的物质的量为a mol,Na2CO3的物质的量为bmol,则氢氧化钠的物质的量为a+0.01 mol;根据钠元素守恒a+ a+0.01+2b=0.09;根据质量守恒84a+40(a+0.01)+106b=5,b=0.02mol,a=0.02mol,原混合物中Na2CO3的质量分数为![]() 42.4﹪; (3)根据以上分析加入盐酸体积与产生CO2体积的关系曲线为
42.4﹪; (3)根据以上分析加入盐酸体积与产生CO2体积的关系曲线为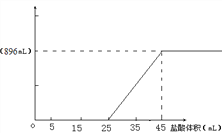 。
。

 阅读快车系列答案
阅读快车系列答案