题目内容
【题目】硫在空气中燃烧可以生成SO2,SO2在催化剂作用下可以被氧化为SO3,其热化学方程式可表示为:S(g) +O2(g)═SO2(g) △H=-297kJ/mol,SO2(g) + 1/2O2(g)![]() SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
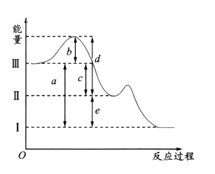
(1)Ⅰ→Ⅱ的反应是________(填“吸热”,“放热”)反应。
(2)c为____________KJ。
(3)图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是______。
A.△H随着b的增大而增大
B.△H随着b的增大而减小
C.△H随着b的减小而增大
D.△H不随b的变化而变化
(4)上图中的d+e-b=________________KJ。
【答案】 吸热 594 D 751.28
【解析】试题分析:
(1)从图像可知,Ⅱ的能量比Ⅰ高,则Ⅰ→Ⅱ的反应是吸热反应。
(2)从图像可知,c为64gS(g)与96g O2(g)完全反应后的热效应,因O2过量,则按照S的物质的量计算,根据S(g) +O2(g)═SO2(g) △H=-297kJ/mol,则64gS(g),即2molS(g)完全反应放出的热量c为297×2=594KJ。
(3)化学反应的反应热与活化能无关,则△H不随b的变化而变化,故选D。
(4)上图中的d+e-b为64gS(g)与96g O2(g)最终反应生成0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)所释放的能量,则64gS(g)与96g O2(g)反应生成2mol SO2(g)时放出594KJ的热量,然后2mol SO2(g)、1mol O2(g)反应生成0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)时共消耗了1.6mol SO2(g),根据SO2(g) + 1/2O2(g)![]() SO3(g);△H ="-98.3" KJ/mol可知,放出热量为98.3 KJ/mol×1.6mol="157.28" KJ。所以共放出热量为594KJ+157.28 KJ="751.28" KJ。即上图中的d+e-b="751.28" KJ。
SO3(g);△H ="-98.3" KJ/mol可知,放出热量为98.3 KJ/mol×1.6mol="157.28" KJ。所以共放出热量为594KJ+157.28 KJ="751.28" KJ。即上图中的d+e-b="751.28" KJ。

 目标测试系列答案
目标测试系列答案【题目】下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
A. A B. B C. C D. D