题目内容
【题目】下图分别代表NaCl、金刚石、干冰、石墨结构的一部分。下列说法正确的是( )
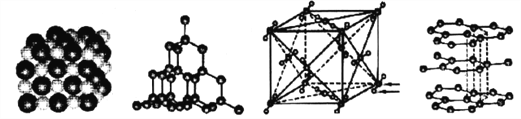
A. NaCl晶体只有在熔融状态下离子键被完全破坏,才能形成自由移动的离子
B. 金刚石中存在的化学键只有共价键,不能导电
C. 干冰中的化学键只需吸收很少的热量就可以破坏,所以干冰容易升华
D. 石墨中碳原子的最外层电子都参与了共价键的形成,故熔点很高、硬度很大。
【答案】B
【解析】A.NaCl是离子化合物,在溶于水或熔融状态下离子键均能被完全破坏,故A错误;B.金刚石为原子晶体,化学键只有共价键,不能导电,故B正确;C.干冰属于分子晶体,干冰升华是物理变化,破坏的是分子间作用力,化学键不变,故C错误;D.石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子,这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键,因而这些π电子可以在整个碳原子平面上活动,类似金属键的性质,石墨为层状结构,层与层之间通过范德华力连接,所以石墨的熔点很高,但硬度较小,故D错误;故选B。

练习册系列答案
相关题目