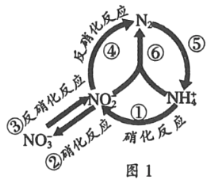
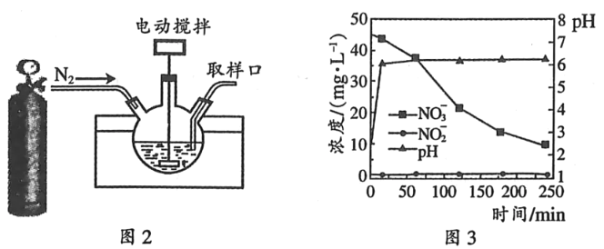
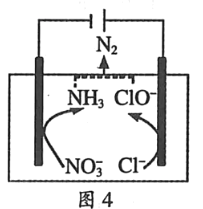
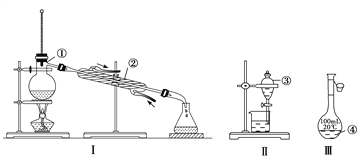
题目内容
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为____________个;
(2)该气体在标准状况下的体积为____________L;
(3)该气体每个分子的质量为_______________g;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
【答案】2mNA/M 22.4m/M M/NA m/MV
【解析】
(1)根据n=m/M及N=nNA计算分子数目,含有原子数目为分子的2倍;
(2)根据n=m/M及V=nVm计算气体体积;
(3)根据n=m/M及N=nNA计算一个分子的质量;
(4)根据c=n/V计算。
(1)该气体的物质的量为![]() =
=![]() mol,因为一个分子中含两个原子,该气体所含原子总数为
mol,因为一个分子中含两个原子,该气体所含原子总数为![]() ×2×NA=2mNA/M;
×2×NA=2mNA/M;
因此,本题正确答案是:2mNA/M;
(2)该气体的物质的量为![]() =
=![]() mol,该气体在标准状况下的体积为
mol,该气体在标准状况下的体积为![]() ×Vm=(m/M) ×22.4=22.4m/M L;
×Vm=(m/M) ×22.4=22.4m/M L;
因此,本题正确答案是:22.4m/M ;
(3)NA个该气体的分子质量总和为Mg,每个分子的质量为M/NAg;
因此,本题正确答案是:M/NA;
(4)根据c=n/V可知,该气体溶于水后形成VL溶液,其溶液的物质的量浓度为![]() /V= m/MV mol/L;
/V= m/MV mol/L;
因此,本题正确答案是:m/MV。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于烧杯中,加入250 mL蒸馏水溶解,然后转移至250 mL容量瓶中定容 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | SO42-的检验 | 先滴加BaCl2溶液再滴加HCl溶液生成白色沉淀证明原溶液中有SO42- |
D | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。 | 溶液中一定含有Fe2+ |
A.AB.BC.CD.D