题目内容
【题目】在水体中部分含氮有机物循环如图1所示.
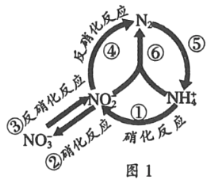
(1)图中属于氮的固定的是____ (填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJmol﹣1
则反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=____kJmol﹣1
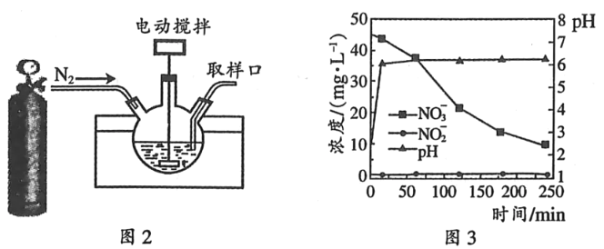
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3﹣,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3﹣起始浓度为45mgL﹣1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3﹣、NO2﹣及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为____.
②向三颈烧瓶中通入N2的目的是____.
③开始反应0~20min,pH快速升高到约6.2,原因之一是___________;NO3﹣还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___
(4)一种可以降低水体中NO3﹣含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
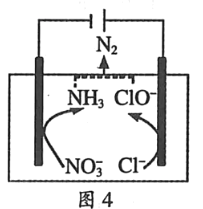
①电解时,阴极的电极反应式为_____.
②溶液中逸出N2的离子方程式为_____.
【答案】⑤ -351 8mol 驱除三颈烧瓶装置中的O2,防止铁粉被O2氧气 铁发生腐蚀消耗H+ 4Fe+NO3﹣+5H2O+2H+=4Fe(OH)2+NH4+ NO3﹣+6H2O+8e﹣=NH3+9OH﹣ 2NH3+3ClO﹣=N2+3Cl﹣+3H2O
【解析】
(1)将游离态的氮(即氮气)转化为化合态的氮(即氮的化合物)的过程,叫做氮的固定;(2)依据盖斯定律计算反应热;(3)反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价﹣1价升高为0价;加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平书写离子方程式;(4)电解池中阴极上是NO3﹣被还原为NH3,失电子发生还原反应;氨气被次氯酸根离子氧化生成氮气,结合电荷守恒和原子守恒配平书写离子方程式。
(1)分析转化关系可知,氮的固定是指单质变化为化合物的反应,所以图中属于氮的固定的是⑤,故答案为:⑤;
(2)①2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
②2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJmol﹣1
依据盖斯定律计算(①+②)×![]() 得到反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=﹣351kJ/mol,故答案为:﹣351;
得到反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=﹣351kJ/mol,故答案为:﹣351;
(3)①反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价﹣1价升高为0价,生成1molFe电子转移8mol,故答案为:8mol;
②向三颈烧瓶中通入N2的目的是将装置内的空气排出,防止铁粉被氧化,故答案为:驱除三颈烧瓶装置中的O2,防止铁粉被O2氧气;
③加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平离子方程式为:4Fe+NO3﹣+5H2O+2H+=4Fe(OH)2+NH4+,故答案为:铁发生腐蚀消耗H+,4Fe+NO3﹣+5H2O+2H+=4Fe(OH)2+NH4+;
(4)①电解池中阴极上NO3﹣被还原为NH3,发生还原反应,电极反应为NO3﹣+6H2O+8e﹣=NH3+9OH﹣,故答案为:NO3﹣+6H2O+8e﹣=NH3+9OH﹣;
②氨气被次氯酸根离子氧化生成氮气,反应的离子方程式为:2NH3+3ClO﹣=N2+3Cl﹣+3H2O,
故答案为:2NH3+3ClO﹣=N2+3Cl﹣+3H2O。