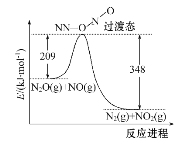
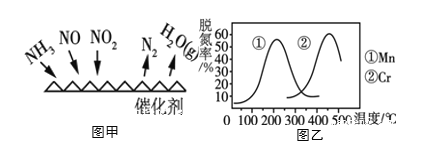
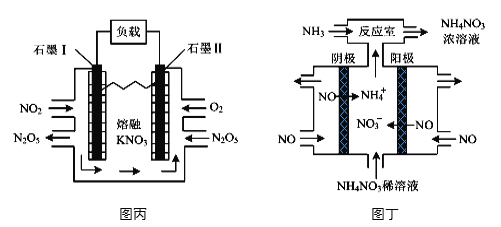
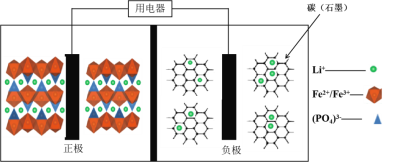
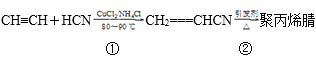题目内容
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
【答案】Fe2O3 Al2O3 D Al3++3NH3·H2O=Al(OH)3↓+3NH4+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- K2SO4和(NH4)2SO4
【解析】
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物甲加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,A Fe2O3,为向NaAlO2溶液中通入过量CO2可得Al(OH)3沉淀和碳酸氢钠,Al(OH)3受热分解生成B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4和(NH4)2SO4,以此来解答。
(1)由上述分析可知,A为Fe2O3,B为Al2O3,
故答案为:Fe2O3;Al2O3;
(2)依据流程分析,向溶液中加入的试剂a应沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,反应方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,
A. NaOH溶液若加入过量会使氢氧化铝沉淀溶解,故A错误;
B. 加稀盐酸不能得到氢氧化铝沉淀,故B错误;
C. 通入二氧化碳不能得到氢氧化铝沉淀,故C错误;
D. 加入氨水可生成氢氧化铝沉淀,且过量氨水不与氢氧化铝反应,故D正确;
故答案为:D;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(3)反应②中二氧化碳过量,反应生成沉淀和碳酸氢钠,向NaAlO2溶液中通入过量CO2可得Al(OH)3沉淀和碳酸氢钠,其离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)向溶液中加入的试剂a应沉淀铝离子,应向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4和(NH4)2SO4;固体D可以作为复合性的化学肥料,D中所含物质的化学式为K2SO4和(NH4)2SO4;
故答案为:K2SO4和(NH4)2SO4。

【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=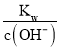 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
【题型】综合题
【结束】
24
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。