题目内容
3.下列化合物中既有离子键又有共价键的是( )| A. | KBr | B. | N2 | C. | HBr | D. | NaOH |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物、铵盐中都含有离子键,据此分析解答.
解答 解:A.KBr中钾离子和溴离子之间只存在离子键,故A错误;
B.氮气分子中N-N原子之间只存在共价键,故B错误;
C.HBr分子中H-Br原子之间只存在共价键,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故D正确;
故选D.
点评 本题考查化学键,侧重考查基本概念,明确物质的构成微粒及微粒之间作用力即可解答,知道常见物质中存在的化学键,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
13.减少CO2的排放以及CO2的资源化利用具有重要意义.
(1)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成铵盐的主要化学方程式CO2+NH3•H2O═NH4HCO3.
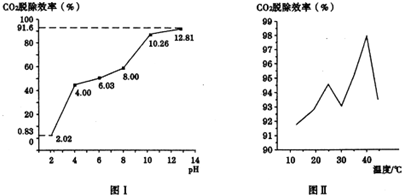
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图Ⅰ所示,CO2脱除效率与吸收剂的pH关系是CO2脱除效率随吸收剂的pH增大而增大.烟气中CO2的含量为12%,烟气通人氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量为0.13mol(精确到0.01).
③CO2脱除效率与温度的关系如图Ⅱ所示.从40℃到45℃脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成二氧化碳.
(2)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为
2H2(g)+CO(g)?CH3OH(g)△H=-90.1kJ/mol.
①在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投人反应物,测得反应达到平衡时的有关数据如下.
下列说法正确的是D(填字母編号).
A.2c1>c3 B.|x|+|y|<90.1 C.2p2<p3 D.a1+a3<1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若甲容器中反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数为44.4%(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).
(1)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成铵盐的主要化学方程式CO2+NH3•H2O═NH4HCO3.
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图Ⅰ所示,CO2脱除效率与吸收剂的pH关系是CO2脱除效率随吸收剂的pH增大而增大.烟气中CO2的含量为12%,烟气通人氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量为0.13mol(精确到0.01).
③CO2脱除效率与温度的关系如图Ⅱ所示.从40℃到45℃脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成二氧化碳.
(2)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为
2H2(g)+CO(g)?CH3OH(g)△H=-90.1kJ/mol.
①在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投人反应物,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.|x|+|y|<90.1 C.2p2<p3 D.a1+a3<1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若甲容器中反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数为44.4%(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).

11.下列各组性质的比较,正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 酸性强弱:H2CO3<H2SiO3<HNO3 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 非金属性强弱:P>S>Cl |
8.某主族元素R的最高化合价与最低负化合价的代数和为2,下列叙述可能正确的是( )
| A. | R为第ⅣA族元素 | B. | R的气态氢化物为H2R | ||
| C. | R能形成含氧酸H2RO4 | D. | R气态氢化物水溶液呈碱性 |
15.下列排列顺序正确的是( )
| A. | 半径:Al3+>Mg2+>Na+>F- | B. | 稳定性:HI<HBr<HCl<HF | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 碱性:Al(OH)3>Mg(OH)2>Ca(OH)2 |
12.根据元素周期表,下列叙述正确的是( )
| A. | 钾与钠同一主族,钠比钾更容易从水中置换出氢 | |
| B. | 溴化钾与碘化钾溶液置于空气中,溴化钾更容易被氧化 | |
| C. | 过渡元素都是副族元素 | |
| D. | 同周期元素的原子,半径越大,越容易失去电子 |
13.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 乙烷不能发生加成反应,而乙烯能发生加成反应 | |
| B. | 苯在50℃~60℃时发生硝化反应,而甲苯在30℃时即可 | |
| C. | 乙烷不能使酸性高锰酸钾溶液褪色,而甲苯能使酸性高锰酸钾溶液褪色 | |
| D. | 乙醇不能与NaHCO3溶液反应,而乙酸能与NaHCO3溶液反应 |