题目内容
【题目】如图所示,将铁棒和石墨棒擦入1 L 1 molL﹣1食盐水中.下列说法正确的是( ) 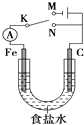
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH﹣﹣4e﹣=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)体时,生成了1 mol NaOH
【答案】D
【解析】解:A、若电键K与N连接,该装置构成了原电池,较活泼的金属铁作负极而加速被腐蚀,故A错误.
B、若电键K与N连接,该装置构成了原电池,不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e﹣=4OH﹣,故B错误.
C.若电键K与M连接,构成电解池,将石墨棒换成铜棒,是电解池的阳极,铁棒是阴极,电解质溶液换成CuSO4溶液就可以实现铁棒上镀铜,如果电解质溶液仍然是氯化钠溶液,不能实现铁棒上镀铜,故C错误;
D.若电键K与M连接,该装置是电解池,电池反应式为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2 ↑,假设只发生2NaCl+2H2O
2NaOH+Cl2↑+H2 ↑,假设只发生2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2 ↑,根据方程式知,当两极共产生28 L(标准状况)体时,生成了1.25molNaOH,实际上氯化钠只有1mol,与实际不符合,则电解过程中还电解水,所以当氯化钠完全电解时,根据原子守恒生成的氢氧化钠是1mol,故D正确;
2NaOH+Cl2↑+H2 ↑,根据方程式知,当两极共产生28 L(标准状况)体时,生成了1.25molNaOH,实际上氯化钠只有1mol,与实际不符合,则电解过程中还电解水,所以当氯化钠完全电解时,根据原子守恒生成的氢氧化钠是1mol,故D正确;
故选D.

【题目】金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:
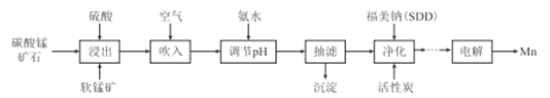
已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(开始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列问题:
(1)FeS2中S元素的化合价为_____价。
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:___
(3)向浸出液中吹入空气的目的是__________(用离子方程式表示)。
(4)调节pH的最佳范围是_______,沉淀的成分是______(填化学式)。
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为__NA。
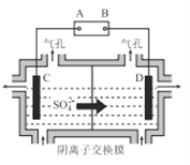
(6)工业上采用如图所示的方法获得金属Mn,B极为____极,若没有阴离子交换膜,Mn2+将在D极发生反应生成MnO2,则电极反应式为____________。