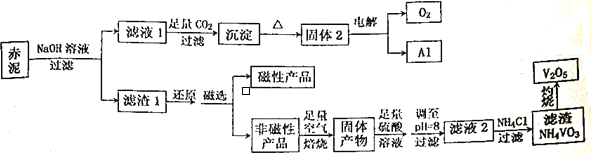
题目内容
【题目】现有A、B、C,D、E、G六种前四周期主族元素,已知A、B、C、D、E五种元素在元素周期表中的位置如图所示。

(1)若非金属元素B的核电荷数为x,则A、B、C、D、E五种元素的核电荷数之和为_________。
(2)若A、B、C、D四种元素的核内质子数之和为56,lmolG的单质与足量盐酸反应,能产生22. 4LH2(在标准状况下);G的阳离子与D的阴离子核外电子层结构相同。
①写出下列元素名称:A_________,B________;
②D的简单离子结构示意图为_________;
③氢化物的沸点:D_________B,简单氢化物水溶液的酸性:B_________C(填“>”“<”或“=”)。
④甲为G、C两元素组成的化合物,用电子式表示甲的形成过程_________。
(3)下列说法正确的是_________(填序号)
A.氢键是极弱的化学键,任何物质中都存在化学键
B.共价化合物中成键原子均满足稀有气体的稳定结构
C.两种非金属元素形成的化合物可能含有离子键
D.化学键断裂,一定发生化学变化
【答案】 5x+10 磷 硫 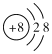 > <
> < ![]() C
C
【解析】(1)用x表示出各元素的核电荷数,求和;(2)若A、B、C、D四种元素的核内质子数之和为56=4x-8,x=16,lmolG的单质与足量盐酸反应,能产生22. 4LH2(在标准状况下),G最外层有两个电子;G的阳离子与D的阴离子核外电子层结构相同,D为氧元素,G为镁元素,以此分析解答。(3)A、氢键是分子间作用力;B、如BF3中B原子周围只有6个电子;C、铵盐由非金属元素形成的离子化合物;D、氯化钠熔化,离子键断裂,不是化学变化。
(1)若非金属元素B的核电荷数为x,A、B、C、D、E的核电荷数分别为:x-1、x、x+1、x-8、x+18,则A、B、C、D、E五种元素的核电荷数之和为5x+10。(2)若A、B、C、D四种元素的核内质子数之和为56=4x-8,x=16,lmolG的单质与足量盐酸反应,能产生22. 4LH2(在标准状况下),G最外层有两个电子;G的阳离子与D的阴离子核外电子层结构相同,D为氧元素,G为镁元素。①元素名称:A、磷,B、硫;②D的简单离子结构示意图为 ;③水分子间形成氢键,沸点比硫化氢高,氢化物的沸点:D>B;,氢硫酸是弱酸,简单氢化物水溶液的酸性,盐酸是强酸:B<C。④甲为G、C两元素组成的化合物,为氯化镁,用电子式表示甲的形成过程
;③水分子间形成氢键,沸点比硫化氢高,氢化物的沸点:D>B;,氢硫酸是弱酸,简单氢化物水溶液的酸性,盐酸是强酸:B<C。④甲为G、C两元素组成的化合物,为氯化镁,用电子式表示甲的形成过程![]() 。(3)A.氢键是是分子间作用力,不是化学键,故A错误;B.共价化合物BF3中B原子周围只有6个电子,不满足稳定结构,故B错误;C.铵盐是由非金属元素形成的离子化合物,所以由非金属元素形成的化合物可能是离子化合物,故C正确;D.如氯化钠熔化,化学键断裂,不发生化学变化,故D错误。
。(3)A.氢键是是分子间作用力,不是化学键,故A错误;B.共价化合物BF3中B原子周围只有6个电子,不满足稳定结构,故B错误;C.铵盐是由非金属元素形成的离子化合物,所以由非金属元素形成的化合物可能是离子化合物,故C正确;D.如氯化钠熔化,化学键断裂,不发生化学变化,故D错误。

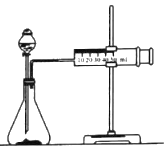
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。某学生为了探究镁条与盐酸反应过程中反应速率的变化,利用如图装置测定一定时间内反应放出氢气的体积(加入稀盐酸的体积为100mL.忽略反应中溶液体积的变化),实验记录如下表(累计值):
时间(min) | l | 2 | 3 | 4 | 5 | 6 |
氢气体积(mL)(标准状况) | 1 | 50 | 120 | 232 | 288 | 310 |
(1)除如图所示的实验用品外,还需要的一件实验仪器是_________。
(2)实验前,检查该装置气密性的方法是_________。
(3)装置气密性良好,0~lmin时间段氢气体积却很少的原因是_________。
(4)反应速率最大的时间段是_________min(填“0~1”1~2”2~3”3~4”“4~5”或“5~6”),原因是_________(从影响反应速率因素的角度解释)。
(5)3~4min时间段,以盐酸的浓度变化来表示的该反应速率为_________(设溶液体积不变)。
(6)由于反应太快,测量氢气体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列液体以减慢反应速率,你认为不可行的是_________(填相应字母)。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液