题目内容
【题目】25℃时,下列各组离子在指定溶液中能大量共存的是( )
A.pH =1的溶液中:NH4+、SO42-、ClO-、Na+
B.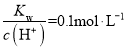 的溶液中:Na+、K+、MnO4-、HCO3-
的溶液中:Na+、K+、MnO4-、HCO3-
C.0.1molL-1的Na2SO3溶液中:H+、K+、SO42-、NO3-
D.澄清透明的溶液中:Fe3+、Na+、Cl-、SO42-
【答案】D
【解析】
A. pH =1的溶液中存在大量氢离子,ClO-与氢离子反应生成次氯酸,在溶液中不能大量共存,故A不符合题意;
B. 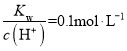 的溶液中,氢氧根离子浓度为0.1molL-1,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故B不符合题意;
的溶液中,氢氧根离子浓度为0.1molL-1,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故B不符合题意;
C. H+、NO3-能够氧化Na2SO3,在溶液中不能大量共存,故C不符合题意;
D. Fe3+、Na+、Cl-、SO42-之间不发生反应,且为澄清透明溶液,在溶液中能够大量共存,故D符合题意;
综上所述,答案为D。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
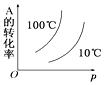
小学同步三练核心密卷系列答案【题目】T℃时,在容积均为0.5L的两个密闭容器中发生:2A(g)+B(g)2C(g)△H=﹣Q kJ/mol (Q>0),6min后,容器①中反应达平衡,有关数据如下表,下列叙述中正确的是
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L·min)
B. ②中达平衡时放出的热量为0.05QkJ
C. 其他条件不变,若容器②保持绝热恒容,则达到平衡时C的体积分数小于2/3
D. 若①达平衡后,再通入1molA与0.5molB,再达平衡时A的转化率增大
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。