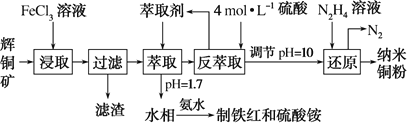
题目内容
【题目】一种以含铁废料(含Fe、FeO、Fe2O3以及不溶于酸的杂质)制备黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:

(1)“酸溶”时,硫酸应过量的原因是____和____。
(2)“氧化”的目的是____。不能用酸性KMnO4溶液检验“氧化”后的溶液中是否含有Fe2+,原因是____。(已知氧化性:酸性KMnO4>Cl2>Fe3+)
(3)如图是温度-pH与生成的含铁化合物的关系图,图中阴影部分是黄钠铁矾稳定存在的区域。
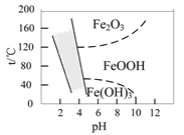
①“沉矾”反应的离子方程式为____。
②若“沉矾”反应在80℃时进行,则需控制溶液的pH范围是____。
③“氧化”后的溶液与Na2CO3溶液发生“沉矾”反应时,适宜的混合方式是____(填字母)。
a.将“氧化”后的溶液与Na2CO3溶液同时加入到反应容器中
b.将“氧化”后的溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有“氧化”后的溶液的反应容器中
【答案】使含铁废料充分溶解 抑制Fe2+、Fe3+水解 将Fe2+氧化为Fe3+ 氧化后的溶液中有Cl-,会使酸性KMnO4溶液褪色 2Na++6Fe3++4SO![]() +6CO
+6CO![]() +6H2O=Na2Fe6(SO4)4(OH)12+ 6CO2 2.5~4.1 c
+6H2O=Na2Fe6(SO4)4(OH)12+ 6CO2 2.5~4.1 c
【解析】
废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑、FeO+H2SO4=FeSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,过滤滤渣是不溶于酸的杂质,而滤液是硫酸钴、硫酸亚铁、硫酸铁与过量的硫酸的混合溶液,向滤液中加氯酸钠将亚铁离子氧化成铁离子,然后加入碳酸钠调节pH=3得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,过滤分离出黄钠铁矾。
(1)“酸溶”时,加入过量硫酸能使含铁废料充分溶解,同时抑制溶液中Fe2+、Fe3+水解;
(2)“氧化”的目的是将溶液中的Fe2+氧化为Fe3+;因溶液中含有Cl-,酸性KMnO4溶液同样能氧化Cl-,使溶液褪色,则无法判断 “氧化”后的溶液中是否含有Fe2+;
(3)①“沉矾”时加入碳酸钠调节pH=3得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,同时有CO2气体生成,则发生反应的离子方程式为2Na++6Fe3++4SO![]() +6CO
+6CO![]() +6H2O=Na2Fe6(SO4)4(OH)12+ 6CO2;
+6H2O=Na2Fe6(SO4)4(OH)12+ 6CO2;
②由图示可知,若“沉矾”反应在80℃时进行,则需控制溶液的pH范围是2.5~4.1左右;
③“氧化”后的溶液与Na2CO3溶液发生“沉矾”反应时,为准确控制溶液的pH应向“氧化”后的溶液滴加Na2CO3溶液,并控制滴加速度,防止滴加的Na2CO3溶液过量,即选项c正确,故答案为c。