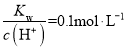题目内容
【题目】已知![]() 在水中的电离方程式为:
在水中的电离方程式为:![]() 。某温度下,向
。某温度下,向![]() 的蒸馏水中加入
的蒸馏水中加入![]() 晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
A.该溶液中![]() 浓度为
浓度为![]()
B.由水电离出来的![]() 的浓度是
的浓度是![]()
C.加入的![]() 的物质的量为
的物质的量为![]()
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
【答案】A
【解析】
A. 向![]() 的蒸馏水中加入
的蒸馏水中加入![]() 晶体,保持温度不变,测得溶液的pH为2,则溶液中的氢离子主要由硫酸氢钠电离出的氢离子提供,故硫酸氢钠电离出的氢离子浓度为
晶体,保持温度不变,测得溶液的pH为2,则溶液中的氢离子主要由硫酸氢钠电离出的氢离子提供,故硫酸氢钠电离出的氢离子浓度为![]() ,根据
,根据![]() ,
,![]() ,故A正确;
,故A正确;
B. 蒸馏水的![]() ,则该温度下的
,则该温度下的![]() ,溶液的pH为2,则溶液中氢离子浓度是
,溶液的pH为2,则溶液中氢离子浓度是![]() ,则溶液中
,则溶液中![]() 的浓度就是
的浓度就是![]() ,则由水电离出来的
,则由水电离出来的![]() 的浓度是
的浓度是![]() ,故B错误;
,故B错误;
C. 由于不知道溶液的体积,故不能计算出硫酸氢钠的浓度,故C错误;
D. 蒸馏水的![]() ,则该温度下的
,则该温度下的![]() ,则pH为12的NaOH溶液的浓度为
,则pH为12的NaOH溶液的浓度为![]() ,则等体积混合后溶液显碱性,D错误;
,则等体积混合后溶液显碱性,D错误;
故选A。

 阅读快车系列答案
阅读快车系列答案【题目】氮的氧化物是造成大气污染的主要物质。
(1)用活性炭还原NO的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
浓度mol/L 时间min | NO | N2 | CO2 |
0 | 10 | 0 | 0 |
10 | 5 | 2.5 | 2.5 |
20 | 2 | 4 | 0.25 |
①在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是____。
②在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正___v逆(填“>”“<”或“=”)。
(2)工业上由N2、H2来制备NH3。不同温度下,向三个相同的容器中投入相同的反应物进行反应,测得不同温度时平衡混合物中NH3的物质的量分数随压强增大而变化如图所示。
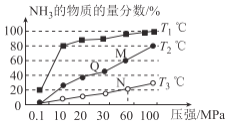
①M点的v正_______Q点的v正(填“>”“<”或“=”)。
②图中三条曲线对应的温度分别为T1、T2、T3,其中温度最高的是____。
③恒温恒容条件下,能说明反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡状态的是____(填选项字母)
2NH3(g)达到平衡状态的是____(填选项字母)
A. 2v(N2)=v(NH3) B.c2(NH3)/[c(N2)c3(H2)]保持不变
C.反应器中的压强不再发生变化 D.3 molH-H键断裂的同时,有2molN-H键断裂
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
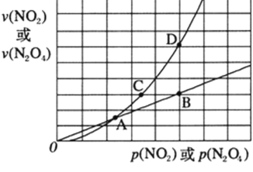
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是______。