题目内容
15.对如表实验现象或操作解释错误的是( )| 现象或操作 | 解 释 | |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 配制SnCl2溶液时,先将SnCl2溶于适量稀盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯水与KI反应生成碘,碘与二氧化硫发生氧化还原反应;
B.配制SnCl2溶液时,应抑制阳离子水解,并防止氧化反应的发生;
C.白色沉淀可能为硫酸钡或AgCl;
D.逐滴加入氨水,首先生成蓝色沉淀,则溶度积小的Cu(OH)2先沉淀.
解答 解:A.氯水与KI反应生成碘,碘与二氧化硫发生氧化还原反应,S元素的化合价升高,SO2具有还原剂,故A错误;
B.配制SnCl2溶液时,先将SnCl2溶于适量稀盐酸,再用蒸馏水稀释,抑制阳离子水解,最后在试剂瓶中加入少量的锡粒防止氧化反应的发生,故B正确;
C.白色沉淀可能为硫酸钡或AgCl,则原溶液可能含银离子或硫酸根离子,但二者不能同时存在,故C正确;
D.逐滴加入氨水,首先生成蓝色沉淀,则溶度积小的Cu(OH)2先沉淀,则Ksp[Cu(OH)2]<Ksp[Mg(OH)2],故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、盐类水解及应用、离子检验、沉淀的生成等,把握物质的性质、化学反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
5.二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-Q1 kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-Q2 kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-Q3 kJ•mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3)kJ/mol.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH (g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(Κ).
①由表中数据判断△H<0 (填“>”、“=”或“<”).能够说明某温度下该反应是平衡状态的是A、C.
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.04.
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨.合成氨反应原理为:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H=-92.4kJ•mol-1.实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1.请回答下列问题: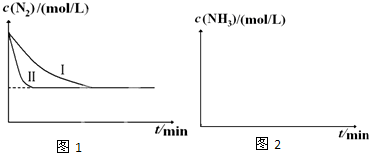
①与实验Ⅰ比较,实验Ⅱ改变的条件为加入催化剂.
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中c(NH3)随时间变化的示意图.
①CO(g)+2H2(g)?CH3OH(g)△H1=-Q1 kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-Q2 kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-Q3 kJ•mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3)kJ/mol.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH (g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(Κ).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.04.
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨.合成氨反应原理为:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H=-92.4kJ•mol-1.实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1.请回答下列问题:

①与实验Ⅰ比较,实验Ⅱ改变的条件为加入催化剂.
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中c(NH3)随时间变化的示意图.
6.下列各实验操作中,可能观察不到溶液产生浑浊现象的是( )
| A. | 氧气通入氢硫酸 | B. | H2S缓慢通入饱和氯水 | ||
| C. | H2S缓慢通入亚硫酸 | D. | SO2缓慢通入氢硫酸 |
3.现代冶炼金属锰的一种工艺流程如下图所示:
下表为t℃时,有关物质的pKp(注:pKp=-1gKp)
①软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4=12MnSO4+6CO2↑+18H2O该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高温度或将软锰矿研细等
②滤液1的pH>(填“>”“<”或“═”)MnSO4浸出液的pH.
③加入MnF2的目的除去Ca2+(填“Ca2+”、“Fe3+”、或“Cu2+”)

下表为t℃时,有关物质的pKp(注:pKp=-1gKp)
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKp | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
②滤液1的pH>(填“>”“<”或“═”)MnSO4浸出液的pH.
③加入MnF2的目的除去Ca2+(填“Ca2+”、“Fe3+”、或“Cu2+”)
10.下列表示对应化学反应的离子方程式,其中正确的是( )
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NaHSO4溶液中加入Ba(OH)2溶液至SO42完全沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | (NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
9.向NaAlO2 溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是( )
| A. | HCl | B. | CO2 | C. | NH3 | D. | CO |