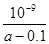题目内容
(14分)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。
已知:H2O(l)=H2O(g) △H=+44kJ·mol—1
CO(g)+H2O(g) CO2(g)+H2(g) △H=—41.2kJ·mol—1
CO2(g)+H2(g) △H=—41.2kJ·mol—1
⑴以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。
⑵CH4和H2O(g)在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
①该反应是_____反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol·L—1,该温度下反应CH4+H2O CO+3H2的平衡常数K= 。
CO+3H2的平衡常数K= 。
⑶汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图。

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出CH4与NO2发生反应的化学方程式: 。
⑷乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2—离子。该电池负极的电极反应式为 。
 CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g) △H=—256.1kJ·mol—1。已知:H2O(l)=H2O(g) △H=+44kJ·mol—1
CO(g)+H2O(g)
 CO2(g)+H2(g) △H=—41.2kJ·mol—1
CO2(g)+H2(g) △H=—41.2kJ·mol—1⑴以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。⑵CH4和H2O(g)在催化剂表面发生反应CH4+H2O
 CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol·L—1,该温度下反应CH4+H2O
 CO+3H2的平衡常数K= 。
CO+3H2的平衡常数K= 。⑶汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图。

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出CH4与NO2发生反应的化学方程式: 。
⑷乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2—离子。该电池负极的电极反应式为 。
⑴—305.7 kJ·mol—1 ⑵①吸热 ②6.75
⑶①该反应是放热反应,升高温度反应更有利于向逆反应方向进行 870℃
②CH4+2NO2→CO2+N2+2H2O ⑷CH3CH2OH—12e—+6O2—=2CO2+3H2O
⑶①该反应是放热反应,升高温度反应更有利于向逆反应方向进行 870℃
②CH4+2NO2→CO2+N2+2H2O ⑷CH3CH2OH—12e—+6O2—=2CO2+3H2O
(1)考查盖斯定律的应用。根据已知反应可知,①-③×2-②即得到2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(l),所以该反应热是-256.1kJ/mol+41.2kJ/mol-44kJ/mol×3=-305.7kJ/mol。
CH3CH2OH(g)+3H2O(l),所以该反应热是-256.1kJ/mol+41.2kJ/mol-44kJ/mol×3=-305.7kJ/mol。
(2)①随着温度的升高,平衡常数逐渐增大,所以正反应是吸热反应。
②平衡时c(CH4)=0.5mol·L—1,所以消耗甲烷是0.5mol/L,则生成CO是0.5mol/L,氢气是
1.5mol/L,剩余甲烷和水蒸气都是0.5mol/L,所以平衡常数为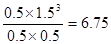 。
。
(3)①应用反应是放热反应,升高温度反应更有利于向逆反应方向进行,所以NO的分
解率降低。根据图像可知,在n(NO)/n(CO)=1的条件下,温度为870℃转化率最高,所以
应该控制的温度是870℃。
②NO2能把甲烷氧化生成CO2、氮气和水,方程式为CH4+2NO2→CO2+N2+2H2O。
(4)原电池中负极失去电子,由于电解质能传递O2—离子,而在原电池中阴离子是向负极
移动的,所以负极方程式为CH3CH2OH—12e—+6O2—=2CO2+3H2O。
 CH3CH2OH(g)+3H2O(l),所以该反应热是-256.1kJ/mol+41.2kJ/mol-44kJ/mol×3=-305.7kJ/mol。
CH3CH2OH(g)+3H2O(l),所以该反应热是-256.1kJ/mol+41.2kJ/mol-44kJ/mol×3=-305.7kJ/mol。(2)①随着温度的升高,平衡常数逐渐增大,所以正反应是吸热反应。
②平衡时c(CH4)=0.5mol·L—1,所以消耗甲烷是0.5mol/L,则生成CO是0.5mol/L,氢气是
1.5mol/L,剩余甲烷和水蒸气都是0.5mol/L,所以平衡常数为
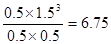 。
。(3)①应用反应是放热反应,升高温度反应更有利于向逆反应方向进行,所以NO的分
解率降低。根据图像可知,在n(NO)/n(CO)=1的条件下,温度为870℃转化率最高,所以
应该控制的温度是870℃。
②NO2能把甲烷氧化生成CO2、氮气和水,方程式为CH4+2NO2→CO2+N2+2H2O。
(4)原电池中负极失去电子,由于电解质能传递O2—离子,而在原电池中阴离子是向负极
移动的,所以负极方程式为CH3CH2OH—12e—+6O2—=2CO2+3H2O。

练习册系列答案
相关题目
 CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母)
CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母) HCOOCH3(g) △H=-29.1 kJ·mol-1
HCOOCH3(g) △H=-29.1 kJ·mol-1
 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol

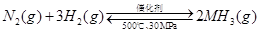 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1