题目内容
【题目】如图所示是配制一定物质的量浓度溶液的过程示意图。下列说法错误的是

A. 所配制的Na2CO3,溶液的物质的量浓度为1.0mol/L
B. 操作2是将溶解的Na2CO3,溶液转移到容量瓶中
C. 操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐
D. 操作4如果仰视,结果配得溶液浓度偏低
【答案】C
【解析】A、由图可知,所配溶液的体积为100mL,10.6g碳酸钠的物质的量为![]() ,所配碳酸钠溶液的浓度为
,所配碳酸钠溶液的浓度为![]() ,选项A正确;B、操作1是溶解碳酸钠固体,由图可知操作2是将溶解得到的碳酸钠溶液转移到容量瓶,选项B正确;C、操作5是定容摇匀,定容摇匀后发现液面低于刻度线,不需再继续加水,否则所得溶液浓度将偏低,选项C错误;D、操作4是定容,应滴加水至溶液凹液面的最低点与刻度线平齐,若仰视,结果配得溶液浓度偏低,选项D正确。答案选C。
,选项A正确;B、操作1是溶解碳酸钠固体,由图可知操作2是将溶解得到的碳酸钠溶液转移到容量瓶,选项B正确;C、操作5是定容摇匀,定容摇匀后发现液面低于刻度线,不需再继续加水,否则所得溶液浓度将偏低,选项C错误;D、操作4是定容,应滴加水至溶液凹液面的最低点与刻度线平齐,若仰视,结果配得溶液浓度偏低,选项D正确。答案选C。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应.应用如图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 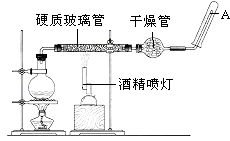
请回答下列的问题.
(1)铁在周期表中的位置是 .
(2)请写出该反应的化学方程式: .
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为 .
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含b mol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO.试回答下列问题: ①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
① | ② | ③ | ④ | |
溶液中的金属离子 | Fe2+ | |||
残留固体成分 | Fe、Pt | Pt | Pt |
②当x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mL NO.则a= , b= .