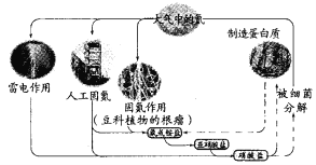
��Ŀ����
����Ŀ�������ŷ�CO2����ɡ�����ЧӦ����Ϊ�˼���úȼ�նԻ�����ɵ���Ⱦ��ú�������Ǹ�Ч���������ú̿����Ҫ;����ú�ۺ����õ�һ��;����ͼ��ʾ�� 
��1����֪C��s��+H2O��g���TCO��g��+H2��g����H1=+131.3kJmol��1 �� C��s��+2H2O��g���TCO2��g��+2H2��g����H2=+90kJmol��1 �� ��һ����̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
��2������ͼԭ���װ�ÿ�����ɹ��̢ݵ�ת������װ��b�缫�ĵ缫��Ӧʽ�� �� 
��3����ѹǿΪ0.1MPa�����£��ݻ�ΪV L���ܱ�������a mol CO��2a mol H2�ڴ��������·�Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ���� ��p1p2�����������������=������
���������������������£���������������a mol CO��2a mol H2 �� �ﵽ��ƽ��ʱ��CO��ƽ��ת���������������С�����䡱���� 
����p1�£�100��ʱ��CO��g��+2H2��g��CH3OH��g����Ӧ��ƽ�ⳣ��Ϊ���ú�a��V�Ĵ���ʽ��ʾ����
��4������ͼ��ʾCO2��H2��Ӧ����CH3OH��H2O�Ĺ�������������λΪkJmol��1���ı仯�� ���ڸ÷�Ӧ������˵���У���ȷ���������ţ���
A.��H��0����S��0
B.��H��0����S��0
C.��H��0����S��0
D.��H��0����S��0
��5��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1L���ܱ������У�����1mol CO2��3mol H2 �� һ�������·�����Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g�������CO2��g����CH3OH��g����Ũ����ʱ��仯��������ͼ��ʾ�� �ٴӷ�Ӧ��ʼ��ƽ�⣬CO2��ƽ����Ӧ����v��CO2��= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����������ţ���
A�������¶�
B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч����
D���ٳ���1mol CO2��3mol H2 ��
���𰸡�
��1��CO��g��+H2O��g��=CO2��g��+H2��g����H=��41.3kJ?mol��1
��2��O2+4e��+2H2O�T4OH��
��3���������� ![]()
��4��C
��5��0.075mol?L��1?min��1��BD
���������⣺��1��C��s��+H2O��g��=CO��g��+H2��g����H1=+131.3kJmol��1��
C��s��+2H2O��g��=CO2��g��+2H2��g����H2=+90kJmol��1��
�ɸ�˹���ɢک��ٵã�
CO��g��+H2O��g��=CO2��g��+H2��g����H=��41.3kJmol��1
���Դ��ǣ�CO��g��+H2O��g��=CO2��g��+H2��g����H=��41.3kJmol��1����2��ȼ�ϵ����ȼ����ԭ��ظ���ʧ���ӷ���������Ӧ�������������õ����������Ի���������ˮ���������缫��Ӧ��O2+4e��+2H2O�T4OH����
���Դ��ǣ�O2+4e��+2H2O�T4OH������3�����¶���ͬʱ������ֱx��ĸ����ߣ�����ѹǿΪP2��CO��ת���ʸߣ��÷�Ӧ����ӦΪ�����С�ķ�Ӧ��ѹǿ����ƽ���������С�ķ����ƶ�����������ӦӦ�ƶ���CO��ת������������P1��P2�����Դ��ǣ����������¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��g����2a mol H2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���CO��ת��������
���Դ��ǣ�������ѹǿΪ0.1MPa�����£��ݻ�ΪV L���ܱ�������a mol CO��2a mol H2�ڴ��������·�Ӧ���ɼ״�����
CO��g��+ | 2H2��g���T | CH3OH��g�� | |
��ʼŨ�� |
|
| 0 |
ת��Ũ�� |
|
|
|
ƽ��Ũ�� |
|
|
|
��K= 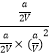 =
= ![]() ��
��
���Դ��ǣ�K= ![]() ����4�����ݷ�Ӧ��ͼ������жϣ�CO2��g��+3H2��g��CH3OH��g��+H2O��g������������ʵ������٣���Ӧ���ؼ��ٵķ�Ӧ��S��0����Ӧ������������������������жϷ�Ӧ�Ƿ��ȷ�Ӧ����H��0��
����4�����ݷ�Ӧ��ͼ������жϣ�CO2��g��+3H2��g��CH3OH��g��+H2O��g������������ʵ������٣���Ӧ���ؼ��ٵķ�Ӧ��S��0����Ӧ������������������������жϷ�Ӧ�Ƿ��ȷ�Ӧ����H��0��
���Դ��ǣ�C����5��������̼�Ƿ�Ӧ���淴Ӧ����Ũ�ȼ�С���״���������淴Ӧ����Ũ������10nim�ڴﵽƽ�⣬���ɼ״�Ũ��Ϊ0.75mol/L��������̼Ũ�ȱ仯��0.75mol/L���ٶ�����̼�ķ�Ӧ����V��CO2��= ![]() =0.075mol/Lmin��
=0.075mol/Lmin��
���Դ��ǣ�0.075 molL��1min��1�ڴ�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����ǣ�
A����Ӧ�Ƿ��ȷ�Ӧ������ƽ��������У���A����
B����CH3OH��g����ʱҺ���������С�����������ƽ��������У���B��ȷ��
C��ѡ���Ч����ֻ�ܸı����ʣ����ı仯ѧƽ�⣬��C����
D���ٳ���l molCO2��4molH2������ѹǿƽ��������У���D��ȷ��
��ѡ��BD��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�����Ŀ��һ�������·�ӦA��g��+B��g��C��g����H��0�ﵽƽ�������ͼ���жϣ�
�ﵽ�µ�ƽ���Ӧ��ͼ�� | ƽ���ƶ����� | |
��i��ʹ�ô��� | ||
��ii������ | ||
��iii����ѹ | ||
��iv������A���� | ||
��v������C���� |