题目内容
【题目】0.94g某有机物在纯氧中完全燃烧,可生成二氧化碳2.64g,水0.54g,同时消耗氧气2.24g.又知此有机物蒸气0.224L(已折算成标准状况下)的质量为0.94g.
(1)求此有机物的分子式.
(2)若此有机物跟FeCl3溶液作用显紫色,写出此有机物的结构简式.
【答案】
(1)解:2.64g二氧化碳的物质的量= ![]() =0.06mol,则0.94g有机物中n(C)=0.06mol,
=0.06mol,则0.94g有机物中n(C)=0.06mol,
0.54g水的物质的量= ![]() =0.03mol,则0.94g有机物中n(H)=0.03mol×2=0.06mol,
=0.03mol,则0.94g有机物中n(H)=0.03mol×2=0.06mol,
消耗氧气2.24g,其物质的量= ![]() =0.07mol,根据O原子守恒可知0.94g有机物中n(O)=0.06mol×2+0.03mol﹣0.07mol×2=0.01mol,
=0.07mol,根据O原子守恒可知0.94g有机物中n(O)=0.06mol×2+0.03mol﹣0.07mol×2=0.01mol,
故则0.94g有机物中n(C):n(H):n(O)═0.06mol:0.06mol:0.01mol=6:6:1,故有机物最简式为C6H6O,
0.94g有机物蒸气0.224L(已折算成标准状况下),其物质的量为 ![]() =0.01mol,故该有机物的相对分子质量=
=0.01mol,故该有机物的相对分子质量= ![]() =94,有机物最简式为C6H6O,最简式相对分子质量为94,故有机物分子式为C6H6O,
=94,有机物最简式为C6H6O,最简式相对分子质量为94,故有机物分子式为C6H6O,
答:该有机物分子式为C6H6O
(2)解:此有机物跟FeCl3溶液作用显紫色,含有酚羟基,该有机物分子式为C6H6O,故其结构简式为 ![]() ,
,
答:该有机物的结构简式为 ![]()
【解析】(1)根据n= ![]() 计算所生产的二氧化碳、水的物质的量,计算消耗氧气的物质的量,根据原子守恒计算有机物中C、H、O原子数目,进而确定最简式,再计算该有机物的相对分子质量,确定其分子式;(2)此有机物跟FeCl3溶液作用显紫色,含有酚羟基,结合有机物分子式书写其结构简式.
计算所生产的二氧化碳、水的物质的量,计算消耗氧气的物质的量,根据原子守恒计算有机物中C、H、O原子数目,进而确定最简式,再计算该有机物的相对分子质量,确定其分子式;(2)此有机物跟FeCl3溶液作用显紫色,含有酚羟基,结合有机物分子式书写其结构简式.

【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4H2O的过程如图所示: 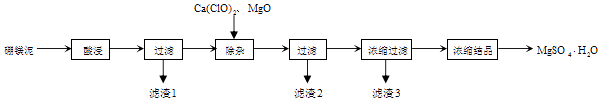
硼镁泥的主要成分如表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
资料:B2O3溶于水形成硼酸,由于硼酸易溶于水,溶解度随温度的升高而升高,而硫酸镁在80℃溶解度最大,所以常规方法很难将二者分离,目前常采用高温结晶法
回答下列问题:
(1)“滤渣1”中主要含有(写化学式)
(2)“滤渣2”中主要含有(写化学式),判断“除杂”基本完成的检验方法正确的是 .
A.取上层清液,滴加苯酚试液不显紫色
B.取上层清液,滴加KSCN,不变红
C.取上层清液,滴加K3[Fe(CN)6]不产生蓝色沉淀
(3)氧化镁的作用是 . 有同学认为用碳酸镁比用氧化镁要好,原因是 .
(4)分离滤渣3应趁热过滤的原因是 . 分离滤渣3后的母液中含有的溶质是和 , 可以采用加压、的方法得到一水合硫酸镁.